 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЛЕКЦИЯ 22. СКОРОСТЬ ЭЛЕКТРОХИМИЧЕСКОЙ КОРРОЗИИ
термодинамика устанавливает возможность протекания процесса коррозии, но не дает реальных представлений о скорости коррозии.
4Al + 3O2 + 6H2О = 4Al(OH)3 , кДж << 0.
Þ коррозия Al под действием О2 возможна, но
Þ Al - конструкционный материал. 
Причина – (продукты коррозии - оксидные, гидроксидные, солевые и др. пленки тормозят дальнейший процесс коррозии) в пассивации металла.
Скорость коррозии
1) Массовый показатель: - потеря массы (в граммах или килограммах) за единицу времени (секунду, час, сутки, год), отнесенную к единице площади (квадратный метр) образца,[г/м2.сут]. - Км
2) Глубинный показатель - уменьшение толщины металла в единицу времени [мм/год].- Кг. Для пересчета единиц есть таблицы.
По скорости коррозии – 3 группы металлов:
а) < 0,15 мм/год – высокая коррозионная стойкость Þметаллы используют для ответственных изделий: валов, поршней насосов, пружин и др.;
б) от 0,15 до 1,5 мм/год – средняя коррозионная стойкость, используют там, где нет повышенных требований к коррозионной стойкости: емкости, трубопроводы, корпуса вентелей, болтов;
в) > 1,5 мм/год – не стойкие, не используются в коррозионной среде
3) Коррозионный ток (плотность коррозионного тока). Скорость электрохимической коррозии можно выразить величиной тока, приходящегося на единицу площади металла, растворенного в единицу времени.
По закону Фарадея: i кор = m F / M э S t, где
М Э молярная масса эквивалента металла, г/моль.
F – число Фарадея,96500 кл
i кор = плотность коррозионного тока, А/м2.
К m, К г, i кор - прямые показатели коррозии
Как и при работе обычного Г.Э. при работе К.Г.Э имеет место поляризация, приводящая к понижению ЭДС и понижению V коррозии. Скорость электрохимической коррозии зависит от скорости лимитирующей стадии.:
V = V лим. ст. (анод: растворение М; катод: поглощение О2, выделение Н2).Чтобы ↓ V нужно ↓ V лим.ст.,т.е. ↑ поляризацию.
Поляризационные кривые коррозионного микроэлемента – коррозионные диаграммы.

Коррозионная диаграмма
Как и в гальваническом элементе, потенциал анодного процесса смещается в более положительную сторону, а катодного - в более отрицательную.
При некотором токе i кор кривые пересекаются. (Ток анодного растворения равен току катодного восстановления окислителя). При этом на поверхности металла устанавливается стационарный потенциал Ес, или потенциал коррозии Е к ор.
1) Лимитирующая стадия – катодное выделение водорода (обычно в кислых средах). Замедленность стадии определяется электрохимической поляризацией при выделении Н2,зависящей от рН, Т,природы катодных участков. Такие примеси как платина, кобальт, никель катализируют выделение водорода. Скорость катодного процесса будет выше, чем на чистом М (поляризация катодной кривой уменьшится) Þ точка пересечения сместится вправо, то есть iк ор увеличится Þ i ’.
Другие металлы(например, ртуть, свинец, кадмий), напротив, увеличивают перенапряжение водорода(поляризация катодной кривой увеличится) Þ iкор уменьшится Þ i”. V = f (рН,Т,природа кат.уч.)
Итак, Скорость коррозии с выделением водорода может быть замедлена снижением температуры, увеличением pH среды, очисткой металла от каталитических примесей, изоляцией поверхности металла. Перемешивание раствора практически не влияет, т.к. поляризация электрохимическая.
2) Лимитирующая - стадия анодного окисления металла.
Для металлов, способных пассивироваться: таких, как хром, алюминий, титан, цирконий, никель, тантал и др. Пассивность – состояние повышенной устойчивости М, вызванное торможением анодной реакции в определенной области потенциалов.При некотором потенциале Епас скорость растворения анода резко падает Þ металл переходит в пассивное состояние. Во всей области пассивности  . В области пассивности анодное растворение протекает крайне медленно.
. В области пассивности анодное растворение протекает крайне медленно.


Коррозионная диаграмма (явление пассивации металла)
Пассивность, в основном, вызывается образованием на поверхности металла оксидных или иных защитных слоев,(например, Сr2О3 на хроме, ТiО2 на титане, Al2О3 на алюминии, Та2О5 - на тантале).
Сильные окислители способствуют или даже вызывают пассивацию металлов, так:
Концентрированные HNO3 и H2SO4 пассивируют железо. Вещества, вызывающие пассивацию М – пассиваторы коррозии (NO3- ,Cr2O72-…) Вещества, стимулирующие коррозию - активаторы. Анионы Cl-, Br- активаторы коррозии, что связано с их высокой адсорбционной способностью и восстановлением пассивной пленки на М. Так, 2Cl-→2Cl-адс+ M(OH)2→MCl2 + 2OH-
Разбавленные кислоты HNO3,H2 SO4 - активаторы коррозии.
A:Fe→Fe2++ 2e
В разбавленной H2SO4
К: 2Н+ + 2e→H2
Fe + H2SO4 →FeSO4 +H2
А: 2Fe+ 3Н2О -6e→Fe2O3 +6H+
В конц. H2SO4
K: 3SO42-+12H+ + 6e→3SO2 +6H2O
2Fe +3 H2 SO4 →Fe2O3 +3SO2 +3H2O
В разбавленной HNO3:
A:Fe→Fe3++ 3e
K:NO3- + 4H+ +3e→NO + 2H2O
Fe + 4HNO3 →Fe(NO3)3 + 2H2O + NO
В концентрированной HNO3:
A: 2Fe+ 3Н2О -6e→Fe2O3 +6H+
K: 6NO3- +12H+ +6e→6NO2 +6 H2O
2Fe + 6HNO3 →Fe2O3 + 6NO2 +3H2O
Влияние рН на скорость. Так, Fe при рН >7 пассивируется(пассив. пленка Fe(OH)2) V = f (C и природы электролита, природы М, рН)
3) Лимитирующая – катодное поглощение кислорода. Замедленность связана с замедленной диффузией кислорода из-за его малой растворимости в воде (при 25 оС растворимость 2,6 • 10-7моль/см3), т.е. поляризация - концентрационная, величина ее зависит от С о2, D,Т.
V = f(Cо2,D, T)
С одной стороны ↑ Т приводит к ↑ D коэффициента диффузии кислорода, с другой - к уменьшению растворимости кислорода в воде.
Таким образом, коррозия с поглощением кислорода лимитируется стадией диффузии кислорода и возрастает с увеличением его концентрации, при перемешивании, экстремально зависит от температуры.
Для борьбы с такой коррозией следует снижать концентрацию кислорода, например, введением восстановителя в раствор (сульфит натрия, гидразин…) или снижением давления кислорода над раствором, подбирать оптимальную Т, подбор ингибиторов ПАВ, избегать перемешивания.
ЛЕЦИЯ 23. ЗАЩИТА МЕТАЛЛОВ ОТ КОРРОЗИИ.
Профилактические и дополнительные меры принимают уже на стадии проектирования машин и оборудования.Профилактические включают:
1) выбор оптимального для данных условий материала (в основном, легированного)
Легирование металлов
Введение в состав материала компонентов, вызывающих не только улучшение механических, характеристик, но и пассивацию металла.
- жаростойкость – стойкость по отношению к высокотемпературной (газовой, химической) коррозии - легирование стали Cr, Al, Si, образуют плотные защитные пленки оксидов.
- жаропрочность – свойство материала сохранять высокую механическую прочность при высоких Т - легирование стали Mo, Mn, Ni.
2) выбор оптимальных с т.зрения борьбы с коррозии конструкторских форм изделия (избегать в коррозионной среде щелей, избегать контакта металлов с большой разницей Е и др.)
3) выбор оптимальных с точки зрения борьбы с коррозией технологич еских параметров (р,Т,С, чистота среды и др.). Так, при атмосферной коррозии в цехе необходим контроль влажности и загрязнения воздуха (кондиционеры, осушка воздуха на адсорбентах).
Дополнительные меры включают:
1) меры, обеспечивающие изоляцию поверхности М от среды за счет неметаллических и металлических покрытий.
2) создание электрозащиты,
3) воздействие на окружающую среду.
Защитные покрытия:
Неметаллические -их защитная функция - изолирующая, предотвращение доступа окислителя к поверхности материалаÞ основное требование к качеству – сплошность, отсутствие пор, эластичность, водонепроницаемость, химическая стойкость.
- неорганические - неорганические эмали, оксиды металлов, хромовые и фосфатные
- органические -наиболее распространенные, -лакокрасочные покрытия, покрытие смолами, пластмассами, полимерными пленками, резиной.
Металлические покрытия (катодные и анодные).
Получают электролизом, химическим восстановлением, термодиффузией, металлизацией. М покрытий – чистые металлы Cr, Ni, Zn, Cd, Al, Cu,, Ag и т.д.; сплавы (бронза, латунь и др.)
Катодные покрытия выполняют из металлов, потенциалы которых в данной среде более положительные, чем потенциал основного металла, напр. Ni, Cu, Sn на Fe.
Анодные покрытия выполняют из металлов, потенциалы которых в данной среде более отрицательные, чем потенциал основного металла, например Zn, Cr, Al на стали.
Пример. Рассмотрим процессы, протекающие на Fe c покрытиями из Sn и Zn в проводящей среде при рН=3 и доступе воздуха.
1) луженое железо Sn/Fe (пищевые емкости, консервные банки и др.)
а) Сравниваем стандартные потенциалы основного металла и покрытия:
Е 0 Sn2+/Sn = - 0,136 B
E 0 Fe2+/Fe = - 0,440 B Þ покрытие катодное.
б) Определяем равновесные потенциалы окислителей в заданной
среде (рН=3)
 ≈ 1,23 – 0,059рН ≈ 1,05В
≈ 1,23 – 0,059рН ≈ 1,05В
 ≈ – 0,059рН ≈ - 0,18В
≈ – 0,059рН ≈ - 0,18В
в) Сравниваем значения потенциалов окислителей и металла-анода, делаем
вывод о возможности данного процесса
коррозии
2 случая:
1. Покрытие не нарушено.
- 0,136 < 1,05 Þ возможна коррозия Sn с поглощением кислорода
- 0,136 > -0,18 Þ не возможна коррозия с выделением водорода
(A) Sn → Sn2+ + 2e
(К) O2 + 4H+ + 4 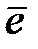 → 2H2О
→ 2H2О
2. Покрытие нарушено.
- 0,44 < 1,05 Þ возможна коррозияFe с поглощением кислорода
- 0,44 < -0,18 Þвозможна коррозия с выделением водорода
(A) Fe → Fe2+ + 2e
(К) 2H+ + 2 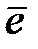 → H2
→ H2
O2 + 4H+ + 4 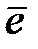 → 2H2O
→ 2H2O

При повреждении катодного покрытия возникает коррозионный ГЭ, в котором основной материал - анод → растворяется, а материал покрытия – катод, → на нем выделяется водород или поглощается кислород.
2) оцинкованное железо Zn/Fe (ведра и др).
а) Сравниваем стандартные потенциалы основного металла и покрытия:
Е 0 Zn2+/Zn = - 0,763 B
E 0 Fe2+/Fe = - 0,440 B Þ покрытие анодное.
б) Определяем равновесные потенциалы окислителей в заданной среде
(рН=3)
 ≈ 1,23 – 0,059рН ≈ 1,05В
≈ 1,23 – 0,059рН ≈ 1,05В
 ≈ – 0,059рН ≈ - 0,18В
≈ – 0,059рН ≈ - 0,18В
в) Сравниваем значения потенциалов окислителей и металла-анода,
делаем вывод о возможности данного процесса коррозии
2 случая:
1. Покрытие не нарушено.
- 0,763 < 1,05 Þ возможна коррозия с поглощением кислорода
- 0,763 < -0,18 Þ возможна коррозия с выделением водорода
(A) Zn → Zn2+ + 2e
(К) O2 + 4H+ + 4 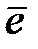 → 2Н2О
→ 2Н2О
2H+ + 2 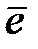 → H2
→ H2
2. Покрытие нарушено.
- 0,763 < 1,05 Þ возможна коррозия с поглощением кислорода
- 0,763 < -0,18 Þ возможна коррозия с выделением водорода
(A) Zn → Zn2+ + 2e
(К) 2H+ + 2 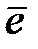 → H2
→ H2
O2 + 4H+ + 4 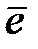 → 2H2O
→ 2H2O
Как видно, процессы при нарушении анодного покрытия не меняются

При повреждении анодного покрытия возникает коррозионный ГЭ, в котором основной материал - катод → не растворяется, на нем выделяется водород или поглощается кислород, а материал покрытия – анод, → разрушается.
ВЫВОДЫ: Катодные покрытия (например, Pb,Cu,Ni) защищают М изделия в основном механически Þ основное требование – сплошность, отсутствие пор, эластичность, водонепроницаемость, химическая стойкость.
Анодные покрытия (например, Al, Zn, Cd) защищают изделие не только механически, но главным образом электрохимически, участвуя в анодном процессе
2. Электрохимическая защита от коррозии - состоит в катодной или анодной поляризации защищаемого М.
1) Суть катодной поляризации: если на изделие извне наложить более отрицательный потенциал, чем у анода коррозионной пары, то анод растворяться не будет.
Два способа:
а) Катодная протекторная защита: к М- изделию, подвергающемуся электрохимической коррозии, подсоединяют протектор - металл с более отрицательным потенциалом, чем металл изделия.
Материалы протекторов - Al, Mg, Zn и сплавы на их основе в виде пластин, брусков и др., которые непосредственно прикрепляются к защищаемому изделию. В коррозионной среде протектор - анод, разрушается, изделие - катод, остается неизменным, идет восстановление окислителя.
ПРИМЕР: протектор Al → Al3+ + 3e или Mg → Mg2+ + 2e,
на стальном (Fe) изделии в морской воде (рН = 8) 2Н2О + 2е → Н2 + 2ОН-
Например, бронзовый подшипник (Sn/Cu) и шейка вала гребного винта (Fe) корабля создают коррозионную пару, в которой разрушается поверхность стального вала, что очень опасно (потеря винта). Если в непосредственной близости прикрепить к корпусу цинковую пластину, то она будет растворяться и держать под отрицательным потенциалом возникшую коррозионную пару, запрещая ее работу.
б) катодная защита - от внешнего источника постоянного тока. Конструкцию (изделие) подключают к отрицательному полюсу – это катод, к положительному полюсу - анод (жертвенный анод) - он разрушается
(например, отработанный стальной рельс и др. лом).
Катодная поляризация используется для защиты подземных трубопроводов, кабелей, шлюзовых ворот, обшивки подводных лодок, водных резервуаров, морских трубопроводов и оборудования химических заводов, корпусов автомобилей.
| Защищаемый М |
| Жертвенный анод |
| Влажная среда почва |
2) Анодная защита - наложение на конструкцию положительного потенциала и перевод ее в пассивное состояние.Метод применим для металлов способных пассивироваться.Требует строгого контроля потенциала, что трудно осуществимо на практике.А: 2Cr + 3H2O – 6e→Cr2O3 + 6 H+
Электрозащита от коррозии применяется при работе гидростанций, морских портовых устройств и т. д.
3. Изменение свойств коррозионной сред (основной метод в теплоэнергетике)
1) Уменьшение концентрации коррозионно опасных компонентов (O2,H+, Cl- СО2 и др.)
2) введение ингибиторов - специальных добавок, замедляющих коррозию.
3) уменьшение выбросов в атмосферу(NOx,SO2,CO2 и др.), осушение воздуха
(на адсорбентах),
4) уменьшение концентрации кислорода О2:
- деаэрация (кипячение),
- барботаж неактивного газа (N2),
- восстановлениес помощью сульфитов, гидразина и др.
O2 + N2H4 = N2 + 2H2O
2Na2SO3 + O2 = 2Na2SO4
5) уменьшение концентрации растворенного СО2:
СО2 + Н2О↔Н2СО3↔Н+ +НСО3-
NH3 + H2CO3 = NH4НСО3
6) снижение концентрации ионов Н+ (гидразин-аммиачный режим ТЭС, рН=9-9,2); (нейтральный режим АЭС) рН↑ вводя известь:
CaO +H+→Ca2++ OH-
7) снижение общего содержания солей (различные методы водоочистки);
8) замена более агрессивных ионов (Cl-) менее агрессивными (NO3-);
Ингибиторы – вещества-замедлители коррозии.
Ингибиторы
/ \
Жидкофазные Газофазные
применяют в замкнутых применяют при
системах при V = const эксплуатации М на воздухе
Механизм действия: ингибитор, адсорбируясь на поверхности М тормозит либо анодный процесс - анодный ингибитор, либо катодный процесс – катодный ингибитор, либо и анодный и катодный процесс - экранирующий ингибитор.
Пример катодного ингибитора: As2O3 (жидкофазный), который отравляет катодные участки поверхности М, где идет выделение Н2 → Е а↑ V корр. ↓.
Анодные ингибиторы: нитриты, хроматы, бихроматы и т.д. Действие - окисление поверхности М с образованием тонкой пленки (0,01 мкм) трудно растворимого соединения с М, которая тормозит анодную реакцию, смещая потенциал в положительную сторону.
Экранирующие ингибиторы коррозии- ПАВ – в основном органические соединения, содержащие NH2- аминогруппу. Действие - адсорбция на границе раздела М - кислота. В результате адсорбции - торможение анодных и катодных процессов.
ВЫВОД: Выбор методов защиты от коррозии определяется природой защищаемого металла, параметрами коррозионной среды, конструкцией, условиями эксплуатации и экономическими соображениями
Поиск по сайту: