 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Анодные процессы
При электролизе веществ используется инертные, не изменяющиеся в процессе электролиза аноды (графитовые, платиновые) и растворимые аноды, окисляющиеся в процессе электролиза легче, чем анионы (из цинка, никеля, серебра, меди и других металлов).
1) Анионы бескислородных кислот (S2ˉ, I¯, Br¯, Cl¯) при их достаточной концентрации легко окисляются до соответствующих простых веществ.
2) При электролизе водных растворов щелочей, кислородсодержащих кислот и их солей, а также плавиковой кислоты и фторидов происходит электрохимическое окисление воды с выделение кислорода:
в щелочных растворах: 4OH¯ - 4e- → O2 + 2H2O
в кислых и нейтральных растворах: 2H2O - 4e- → O2 + 4H+
15.3. Количественно процессы электролиза оцениваются законами Фарадея: масса электролита, подвергшаяся превращению при электролизе, а также массы образующихся на электродах веществ прямо пропорциональны количеству электричества, прошедшего через раствор или расплав электролита, и эквивалентным массам соответствующих веществ.
Закон выражается уравнением
 или
или  , (6)
, (6)
где m - масса образовавшегося или подвергшегося превращению вещества;
М - мольная масса этого вещества;
n - число молей электронов, участвующих в процессе образования 1 моля вещества;
I - сила тока, А;
t - время электролиза, с;
F - постоянная Фарадея, (96500 Kл/моль);
Э - эквивалентная масса вещества;
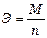 . (7)
. (7)
Для вычисления объема выделяющегося газа (V) уравнение имеет вид:
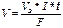 , (8)
, (8)
где V э =  ; V э - эквивалентный объем газа.
; V э - эквивалентный объем газа.
При нормальных условиях эквивалентный объем водорода равен 11,2 л/моль, а кислорода 5,6 л/моль.
Выходом по току называют ту долю от общего количества электричества (Q = I * t), которая расходуется на данную электродную реакцию или отношение массы выделившегося вещества m практ к теоретически возможной m теор по уравнению Фарадея
 . (9)
. (9)
Поиск по сайту: