 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Примеры решения задач. П р и м е р 1. Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 часа при силе тока 4А?
П р и м е р 1. Какая масса меди выделится на катоде при электролизе раствора CuSO4 в течение 1 часа при силе тока 4А?
Р е ш е н и е. Согласно законам Фарадея:
m = ЭIt/96500, (1)
где m – масса вещества, окисленного или восстановленного на электроде;
Э – эквивалентная масса вещества;
I – сила тока, А;
t – продолжительность электролиза, с.
Эквивалентная масса меди в CuSO4 равна 63,54  2 = 31,77г/моль. Подставив в формулу (1) значения Э = 31,77; I = 4А; t = 60
2 = 31,77г/моль. Подставив в формулу (1) значения Э = 31,77; I = 4А; t = 60  60 = 3600с, получим:
60 = 3600с, получим:
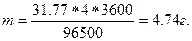

П р и м е р 2. Вычислите эквивалентную массу металла, зная, что при электролизе раствора хлорида этого металла затрачено 3880Кл электричества и на катоде выделяется 11,742г металла.
Р е ш е н и е. Из формулы (1):
Э = 11,742  96500/3880 = 29,35г/моль,
96500/3880 = 29,35г/моль,
где m = 11,742г; It = Q = 3880Кл.
П р и м е р 3. Чему равна сила тока при электролизе раствора в течение 1ч 40мин 25с, если на катоде выделилось 1,4л водорода (н.у.)?
Р у ш е н и е. Из формулы (1):
I = m  96500
96500  Эt.
Эt.
Так как дан объем водорода, то отношение m/Э заменяем отношением VH 
 VЭ(H
VЭ(H  ), где VH
), где VH  − объем водорода, л; VЭ(H
− объем водорода, л; VЭ(H 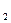 ) – эквивалентный объем водорода, л. Тогда I = VH
) – эквивалентный объем водорода, л. Тогда I = VH 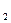
 96500/ VЭ(H
96500/ VЭ(H 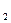 ).
).
Эквивалентный объем водорода при н. у. равен половине молярного объема 22,4/2 = 11,2л. Подставив в приведенную формулу значения VH 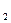 = 1,4 л, t = 6025 (1ч 40мин 25с), находим I = 1,4
= 1,4 л, t = 6025 (1ч 40мин 25с), находим I = 1,4  96500/11,2
96500/11,2  6025 = 2А.
6025 = 2А.
П р и м е р 4. Какая масса гидроксида калия образовалась у катода при электролизе раствора К2SO4, если на аноде выделилось 11,2л кислорода (н. у.)?
Р е ш е н и е. Эквивалентный объем кислорода (н. у.) 22,4/4 = 5,6л. Следовательно, 11,2л содержат две эквивалентные массы кислорода. Столько же эквивалентных масс KOH образовалось у катода, или 56,11  2 = 112,22г (56,11г/моль – молярная и эквивалентная масса KOH).
2 = 112,22г (56,11г/моль – молярная и эквивалентная масса KOH).
Поиск по сайту: