 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Поступление ионов в апопласт
Апопласт корней выполняет многочисленные функции, и важнейшие из них — поглощение воды и минеральных веществ. Питательные вещества не просто проходят через этот компартмент на пути к плазмалемме, но благодаря физико-химическим свойствам этой структуры включаются в создание «внутренней физиологической среды» организма. Минеральные ионы попадают в апопласт корня из почвенного раствора путем диффузии либо в результате конвекционных потоков (массового тока), связанных с перемещением воды по градиенту водного потенциала.
Поступление в апопласт, а точнее в его часть, названную клеточным свободным пространством (СП), структурно представляющим собой систему межмицеллярных и межфибриллярных пор и межклетников, исчисляется минутами. Проводимость клеточной стенки для воды по сравнению с плазмалеммой значительно выше. Коэффициент проницаемости Р свободного пространства для ионов также значительно выше (≈10-5—10-4 м • с-1), чем у клеточной мембраны
(≈10-10—10-9 м• с-1). Высокая проводимость обеспечивается тем, что поры в клеточной стенке имеют диаметр на порядок больше (3 — 4 нм), чем гидратированные ионы (диаметр К+ — 0,54 нм). Но пропитывание матрикса клеточной стенки суберином или лигнином уменьшает проводимость для воды и ионов до величин, которые соответствуют или даже ниже проницаемости плазмалеммы.
С позиций физической химии СП корня представлено двумя составляющими: «водным свободным пространством» (ВСП) и «доннановским свободным пространством» (ДСП) (рис. 6.9). Доннановское СП обусловлено наличием фиксированного отрицательного заряда клеточной стенки, который взаимодействует с поступающими катионами и определяет возникновение доннановского потенциала. Количественная оценка СП, его составляющих, а также поступление в ВСП и ДСП могут быть получены в экспериментах с корнями, когда оценивается динамика поступления (входа) и выхода иона. Кривую поступления, например, 86Rb+ (аналог К+) в корни растения можно разделить на две составляющие (рис. 6.9): / — быстрое начальное поглощение, которое заканчивается в течение 10 мин, //— последующее стационарное поглощение, которое может продолжаться много часов. Быстрое поглощение обратимо, малоизбирательно и практически не зависит от метаболизма (не меняется под действием ингибиторов и в отсутствие О2).

Рис. 6.9. Поглощение К+ (использован его аналог 86Rb+) и его выход из свободного пространства корней кукурузы (Sutcliffe, Baker, 1974, цит. по Baker, Hall, 1988):
ВСП — водное свободное пространство; ДСП — доннановское свободное пространство; /, // —
см. в тексте
Если растение переместить на воду, то большая доля от поглощенного в начальную фазу 86Rb+ будет быстро вымыта из корней. Эта часть составляет «водную обменную фракцию», а поступление иона в корни, равное его выходу, — поступление в ВСП. Из корней, перенесенных затем на раствор КС1, будет выходить 86Rb+, который относится к ионной обменной фракции. В этом случае поступающий К+ замещает 86Rb+, адсорбированный клеточной стенкой, и равная вышедшему 86Rb+ доля К+ соответствует поступлению в ДСП клеточной стенки. Считается, что оставшаяся в корне фракция — ионы, поступившие в симпласт.
Оценив количество К+ (86Rb+), вымытого из корней в воду, и допустив, что концентрация иона во внешнем растворе и в растворе клеточной стенки равны, можно рассчитать объем СП корня. При таком способе расчета не учитывается количество иона, которое находится в адсорбированном состоянии, поэтому полученные величины объема СП завышены. В связи с этим процентные величины объема стали рассматривать как оценку размеров «кажущегося СП» (КСП). Его относительная величина составляет 5 — 7 % (не более 10 %) от общего объема тканей корня. В настоящее время такого рода оценка СП используется редко, и современные исследователи предпочитают для характеристики ВСП и ДСП использовать единицы количества (рис. 6.9) либо концентрации иона, а не единицы объема. Считается, что в среднем отношение ВСП: ДСП составляет 4:1.
Количественные параметры ВСП и ДСП позволяют более точно и правильно оценить функции клеточной стенки и в целом апопласта. Присутствие фиксированных отрицательно заряженных групп в клеточной стенке влияет на поступление ионов в апо-пласт и их накопление. Благодаря заряженным группам стенка обладает катионно-обменной способностью (КОС). При этом 70 — 90% КОС связано с карбоксильными группами галактоу-роновых кислот пектина, а вклад дру-
гих полисахаридов матрикса и белков
составляет 10 — 30 %. Аминогруппы белков определяют способность обмена с анионами; безусловно, она более слабая, чем возможность обмена с катионами.
Рис. 6.10. Эффективность нейтрализации отрицательного заряда клеточной стенки (КС) моно- и поливалентными катионами (по Haynes, 1980)

Модель поступления ионов в апопласт корня учитывает существование двойного электрического слоя (рис. 6.10) и описывает клеточную стенку как систему отрицательно заряженных пор, на поверхности которых адсорбируются подвижные катионы и образуется двойной заряженный слой. Распределение поступающих ионов внутри порового пространства зависит от плотности их электрического заряда, размера поры, а также от знака, и величины заряда иона. Поливалентные катионы экранируют отрицательный заряд КС более эффективно, чем моновалентные, и насыщение СП двух- и поливалентными катионами способствует сохранению большого свободного просвета в поре для перемещения других ионов.
При диффузии ионов в системе с фиксированным зарядом, подобной КС, возникает градиент электрического потенциала (рис. 6.11). Когда ионы диссоциированной соли «К+А-» перемещаются в водной фазе системы, где имеется фиксированный заряд (X  ), катион К
), катион К  будет перемещаться в направлении заряда X
будет перемещаться в направлении заряда X  , нейтрализуя его и оставляя сопутствующий анион A
, нейтрализуя его и оставляя сопутствующий анион A  . Катион К
. Катион К  будет диффундировать так, чтобы сбалансировать заряд А
будет диффундировать так, чтобы сбалансировать заряд А  однако в своем движении он будет ограничен А
однако в своем движении он будет ограничен А  . В результате происходит разделение зарядов и возникает градиент электрического потенциала ED. Его величина при равновесном распределении может быть рассчитана по уравнению Доннана (рис. 6.11).
. В результате происходит разделение зарядов и возникает градиент электрического потенциала ED. Его величина при равновесном распределении может быть рассчитана по уравнению Доннана (рис. 6.11).

Рис. 6.11. Возникновение доннановского потенциала (ED) в системе клеточная стенка—раствор:
X  — фиксированный отрицательный заряд клеточной стенки; K
— фиксированный отрицательный заряд клеточной стенки; K  и K
и K  — одновалентные катионы; А
— одновалентные катионы; А  и А
и А  — одновалентные анионы диссоциированной соли. Стрелки указывают на перемещение ионов; большая стрелка отражает возникновение градиента электрического потенциала.
— одновалентные анионы диссоциированной соли. Стрелки указывают на перемещение ионов; большая стрелка отражает возникновение градиента электрического потенциала.
ЕD=  , где R — газовая постоянная; Т — абсолютная температура;
, где R — газовая постоянная; Т — абсолютная температура;
F — число Фарадея; z — заряд иона; 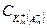 и
и  — концентрации ионов А
— концентрации ионов А  и К+ в
и К+ в
клеточной стенке (in) и в растворе (out)
При доннановском равновесии фаза, содержащая недиффундирующий заряд (в данном случае КС), имеет более высокую концентрацию ионов, чем внешняя фаза (раствор), и будет обладать более высоким осмотическим давлением (или более низким водным потенциалом ψ  ) что важно для поступления воды в апопласт корня.
) что важно для поступления воды в апопласт корня.
Модель двойного слоя — большое упрощение комплексной системы СП. В корневом волоске ион от поверхности корня до следующей клетки коры проходит через КС по системе пор диаметром 3 — 3,5 нм путь длиной в 100 000 нм. Сопротивление диффузии в этом пути для одновалентных катионов в 100—1000 раз, а для одновалентных анионов в 10 раз больше по сравнению с сопротивлением в слое раствора такой же толщины. Поскольку клеточная стенка заряжена отрицательно, перемещение катионов в ней может быть уподоблено движению по хроматографической колонке за счет их ассоциации-диссоциации на обменных местах. Но обычно КОС клеточных стенок корня полностью реализована, и большинство отрицательно заряженных мест занято Са2+. Тогда по аналогии с колонкой поступление новых ионов с одной стороны стенки (из среды) должно приводить к их высвобождению с другой. Однако подобная модель также является упрощением, так как «удаление» ионов из клеточной стенки со стороны, граничащей с протопластом, определяется их транспортом через плазмалемму. Внешняя сторона этой мембраны — не только граница симпласта, но и зона отделения от апопласта. И плазмалемма вносит «метаболическую» компоненту в пассивное, в целом, поступление ионов в КС и их перемещение в ней.
Итак, поступление ионов в СП корня и их перемещение в нем происходит с конвекционным потоком вместе с водой, а также с помощью диффузии. При наличии фиксированного заряда ионы концентрируются преимущественно в растворе апопласта коры корня (или только КС эпидермиса при низкой концентрации в среде) по сравнению с раствором. Эти процессы происходят по тем же физико-химическим законам, как и в капиллярах почвы вблизи отрицательно заряженных глинистых минералов или органических веществ. Однако апопласт — это внутренняя «физиологическая среда», подвергающаяся изменениям, связанным с обменом веществ, не только в период формирования клеточных стенок, но и в зрелых тканях (особенно при механических, химических, биологических воздействиях). Как модифицируется этот компартмент в разных физиологических ситуациях и в какой мере поступление, перемещение и накопление ионов в апопласте корня определяют интенсивность и характер поглощения ионов интактным растением, пока неясно.
Поиск по сайту: