 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
РАСЧЕТ ТЕМПЕРАТУРЫ И ДАВЛЕНИЯ ВЗРЫВА
Для каждой горючей смеси газов существуют две теоретические температуры взрыва – при постоянном давлении Тp и постоянном объеме ТV, причем всегда Тp < ТV. Это связано с тем, что удельная теплоемкость при постоянном давлении больше удельной теплоемкости при постоянном объеме (cp > cV). Температура Тp соответствует взрыву на открытом воздухе, а ТV – взрыву в замкнутом объеме или помещении. Расчет температур взрыва Тp и ТV базируется на уравнениях теплового баланса:
 ; (8.5)
; (8.5)
 (8.6)
(8.6)
Здесь Q – теплота горения вещества;
 ,
, 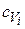 , Vi – удельные теплоемкости и объемные доли компонентов, входящих в продукты взрыва.
, Vi – удельные теплоемкости и объемные доли компонентов, входящих в продукты взрыва.
Значения теоретической температуры взрыва рассчитываются с помощью уравнений теплового баланса (8.5), (8.6):
 ;
;  .
.
Разность между теоретической и действительной температурой взрыва значительно меньше, чем соответствующая разность между температурами горения. Это связано с тем, что при взрыве процесс протекает при условиях, близких к адиабатическим. При этом, ввиду того, что процесс взрыва протекает чрезвычайно быстро, потери теплоты в окружающую среду малы.
Давление при взрыве смеси горючих газов с воздухом в замкнутом объеме зависит от температуры взрыва и отношения числа молекул продуктов горения к числу молекул во взрывчатой смеси. При взрыве газовых смесей избыточное давление обычно не превышает 1 МПа. При замене воздуха во взрывчатой смеси на кислород, давление при взрыве резко увеличивается за счет увеличения температуры горения. Это связано с тем, что значительное количество теплоты затрачивается на нагрев инертного газа – азота, входящего в состав воздуха. При замене воздуха на кислород, давление взрыва для большинства горючих веществ увеличивается от 1 МПа до (1.5÷2) МПа.
Для расчета давления взрыва используется формула
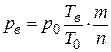 , (8.6)
, (8.6)
где Т0 – начальная температура смеси, K;
Тв – температура взрыва, К (в зависимости от условий взрыва в качестве температуры взрыва используются либо Tp либо TV);
р0 и рв – начальное давление среды и давление при взрыве, МПа;
m – число молекул в химической формуле исходной взрывчатой смеси;
n – число молекул в химической формуле продуктов взрыва.
В качестве примера определим давление при взрыве окиси углерода на открытом воздухом при следующих условиях:
р0 =0.1 МПа; Т0 =293 К (или +20°С); Тв = Тp =2416 К.
· Найдем значения m и n в соответствии с протекающей реакцией:
2СО+О2=2 СО2.
При этом m =3, n =2, так как взрывчатая смесь содержит две молекулы СО и одну молекулу кислорода, а продукты взрыва содержат две молекулы СО2.
· Определим давление взрыва по формуле (8.6):
 .
.
Таким образом, при взрыве смеси воздуха с угарным газом на открытом воздухе развивается давление 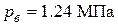 .
.

Поиск по сайту: