 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекция 1. Металлы и периодический закон
ОБРАЩЕНИЕ К ЧИТАТЕЛЮ...................................................................................................................... 2
ЧАСТЬ ПЕРВАЯ........................................................................................................................................... 5
Глава первая. ТЕОРИЯ ГОСУДАРСТВА И ПРАВА КАК ОБЩЕСТВЕННАЯ НАУКА........................ 5
Глава вторая. ПРОИСХОЖДЕНИЕ ГОСУДАРСТВА........................................................................... 13
Глава третья. ПРОИСХОЖДЕНИЕ ПРАВА.......................................................................................... 30
Глава четвертая*. ХАРАКТЕРИСТИКА И ПОНЯТИЕ ГОСУДАРСТВА............................................. 43
Глава пятая*. УСТРОЙСТВО ГОСУДАРСТВА.................................................................................... 60
Глава шестая*. ФУНКЦИИ И ОБЕСПЕЧИВАЮЩАЯ ИХ СТРУКТУРНАЯ ОРГАНИЗАЦИЯ ГОСУДАРСТВА............................................................................................................................................... 85
Глава седьмая. ГОСУДАРСТВО В ПОЛИТИЧЕСКОЙ СИСТЕМЕ ОБЩЕСТВА................................ 96
Глава восьмая. ТЕОРЕТИЧЕСКИЕ ВОПРОСЫ РОССИЙСКОЙ ГОСУДАРСТВЕННОСТИ............ 104
ЧАСТЬ ВТОРАЯ....................................................................................................................................... 154
Глава девятая. ТЕОРИЯ ПРАВА КАК ЮРИДИЧЕСКАЯ НАУКА..................................................... 154
Глава десятая. ПРАВО В СИСТЕМЕ СОЦИАЛЬНЫХ РЕГУЛЯТОРОВ............................................ 180
Глава одиннадцатая. СУЩНОСТЬ И СОДЕРЖАНИЕ, ПОНЯТИЕ И ОПРЕДЕЛЕНИЕ ПРАВА....... 193
Глава двенадцатая. ФОРМА ПРАВА................................................................................................... 206
Глава тринадцатая. НОРМА ПРАВА................................................................................................... 220
Глава четырнадцатая. СИСТЕМА И СТРУКТУРА ПРАВА................................................................ 228
Глава пятнадцатая. ПРАВОВЫЕ ОТНОШЕНИЯ................................................................................ 237
Глава шестнадцатая. ПРАВОТВОРЧЕСТВО....................................................................................... 250
Глава семнадцатая. РЕАЛИЗАЦИЯ ПРАВА....................................................................................... 261
Глава восемнадцатая. ТОЛКОВАНИЕ ПРАВОВЫХ НОРМ............................................................... 273
Глава девятнадцатая. ПРАВОМЕРНОЕ ПОВЕДЕНИЕ, ПРАВОНАРУШЕНИЕ И ЮРИДИЧЕСКАЯ ОТВЕТСТВЕННОСТЬ.................................................................................................................................... 278
Глава двадцатая. ПРАВОСОЗНАНИЕ И ПРАВОВАЯ КУЛЬТУРА................................................... 293
Глава двадцать первая. ПРАВО И ЛИЧНОСТЬ.................................................................................. 301
Глава двадцать вторая. ГРАЖДАНСКОЕ ОБЩЕСТВО И ПРАВОВОЕ ГОСУДАРСТВО............... 312
Содержание........................................................................................................................................... 319
Лекция 1. Металлы и периодический закон
Физико-химические свойства металлов. Металлы отличаются большим разнообразием физико-химических свойств, определяющих и области их применения, и методы их получения. Важнейшие свойства металлов: температура плавления; тепловое расширение; теплопроводность; теплоемкость; электропроводность; электрическое сопротивление; магнитная восприимчивость (таблица 1). Механические свойства в большинстве случаев определяют потребности и потребление металлов и сплавов, производимых в наибольших количествах. Механические свойства характеризуются многими параметрами. Важнейшими из них являются модуль упругости сдвига и твердость, которые характеризуются: модулем упругости, модулем сдвига, твердостью.
 Для оценки химической активности металлов значение имеют электрохимические свойства металлов, характеризуемые положением металла в электрохимическом ряду напряжений. При проведении металлургических и теплотехнических расчетов необходимо знать теплоемкости металлов и их соединений.
Для оценки химической активности металлов значение имеют электрохимические свойства металлов, характеризуемые положением металла в электрохимическом ряду напряжений. При проведении металлургических и теплотехнических расчетов необходимо знать теплоемкости металлов и их соединений.
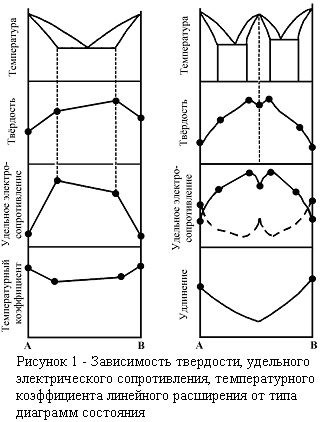
Свойства сплавов зависят от характера взаимодействия компонентов в процессе сплавления и кристаллизации. Существует связь между свойствами сплава и его диаграммой состояния.
На рисунке 1 показаны принципиальные зависимости свойств сплавов от типа диаграмм состояния. По диаграммам состояния можно прогнозировать технологические свойства сплавов. Чем больше температурный интервал между линиями ликвидуса и солидуса, тем больше склонность сплава к ликвации и склонность к образованию трещин. Лучшими литейными качествами и обрабатываемостью резанием обладают эвтектические сплавы. Твердые растворы хорошо деформируются в холодном и горячем состояниях. На структуру сплава влияет скорость охлаждения.
Металлы в системе элементов Д.И. Менделеева. Основными и наиболее распространенными способами представления Периодической системы, которые используются в литературе (науке), являются длинно- (рисунок 3) и короткопериодная (рисунок 2)ее формы.
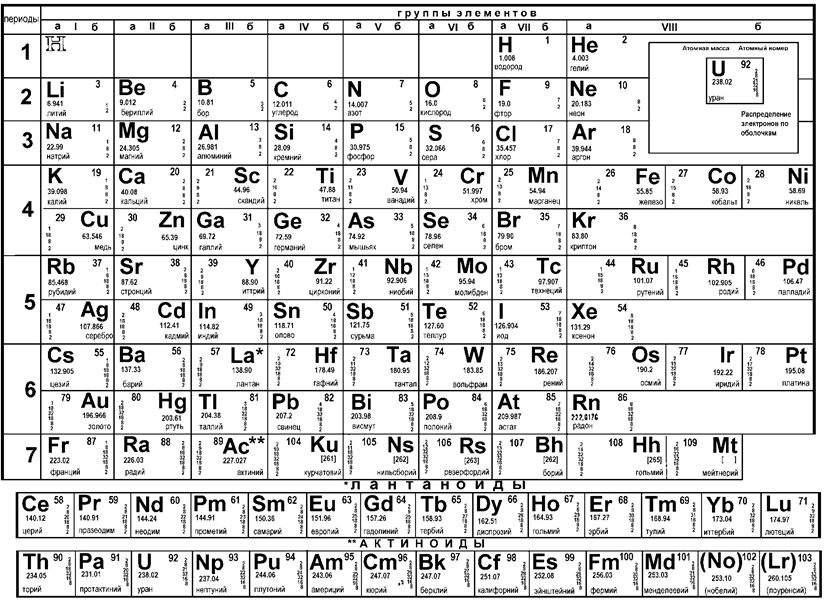
Рисунок 2 - Периодическая система элементов Д.И. Менделеева (короткопериодная форма)
Таблица 1 - Физико-химические свойства основных цветных металлов
| Металл | Cимвол | Атомный номер | Атомная масса | Плотность тв/ж, кг/м3 | Температура плавления, К | Удельная теплота плавления, кДж/кг | Температура кипения, К | Теплопроводность при 293 К, Вт/{м·К) | Удельное электрическое сопротивление при 298 К, мкОм·м |
| Медь | Сu | 63.546 | 8930/8400 | 212.0 | 0.0167 | ||||
| Никель | ni | 58.71 | 309.2 | 90.9 | 0.0684 | ||||
| Цинк | Zn | 65.37 | 7140/6920 | 692.5 | 109.0 | 0.0592 | |||
| Свинец | Pb | 207.19 | 11340/1065 | 600.3 | 26.2 | 35.3 | 0,206 | ||
| Олово | Sn | 118.69 | 7300/6990 | 504.9 | 60.8 | 67.2 | 0.11 | ||
| Сурьма | Sb | 121.75 | 6691/6550 | 903.5 | 160.5 | 24.4 | 0.39 | ||
| Кадмий | Cd | 112.40 | 8650/7990 | 55.3 | 92.2 | 0.0683 | |||
| Висмут | Bi | 209.00 | 9800/10040 | 544,3 | 184.4 | 8,4 | 1.07 | ||
| Кобальт | Co | 58.94 | 244.7 | 0.0624 | |||||
| Золото | Аu | 197.00 | 19320/17240 | 67.5 | 0.0235 | ||||
| Серебро | Ag | 107.87 | 10500/9270 | 1233,8 | 104.8 | 0.016 | |||
| Платина | Pt | 195.09 | 112.7 | 71.6 | 0.106 | ||||
| Алюминий | Al | 26.98 | 2700/2460 | 395.9 | 222.1 | 0.0265 | |||
| Магний | Mg | 24.32 | 1740/1570 | 368.7 | - | 0.0445 | |||
| Титан | Ti | 47,90 | 435.8 | 21.9 | 0.435 | ||||
| Вольфрам | W | 183.92 | 184.4 | 0.056 | |||||
| Молибден | Mo | 95.94 | 292.5 | 0.052 | |||||
| Галлий | Ga | 69.72 | 302.8 | 80.3 | 40.8 | 0.136 (273 К) | |||
| Индий | In | 114.76 | 28.5 | 81.8 | 0.0837 | ||||
| Таллий | Tl | 204.39 | 21.1 | 46.1 | 0.18 (273 К) | ||||
| Германий | Ge | 72.60 | 443.0 | 60.2 | 0.46 | ||||
| Селен | Se | 78.96 | 68.7 | 4.5 | 8·104 | ||||
| Теллур | Те | 127.61 | 134.1 | 19.7 | 4.3·103 | ||||
| Скандий | Sc | 44.96 | 354.1 | 15.8 | 0.20 (273 К) | ||||
| Уран | U | 238.07 | 82.7 | 27.3 | 0.30 |

Рисунок 3 - Периодическая система элементов Д.И. Менделеева (длиннопериодная форма)
Обе формы взаимодополняющие. Число электронов у элементов в наружной оболочке и энергия их связи с ядром определяют химические свойства элементов, их валентные состояния и, что особенно важно для металлургов, металлические свойства элементов. Для металлов более характерна способность к образованию положительных ионов, т.е. к потере электронов.
При рассмотрении Периодической таблицы можно видеть, что эти свойства элементов в направлении слева направо постепенно теряются. Именно этим и объясняется тот факт, что все неметаллы располагаются в правой части таблицы. Исключение составляет только водород, который часто помещают над щелочными металлами.
Металлические свойства элементов усиливаются также и в направлении сверху вниз. Самым «металлическим» элементом является цезий, а самым «неметаллическим» - фтор.
Минералы, их свойства и классификации. Основной формой существования химических элементов в горных породах являются минералы - природные химические соединения. Количество минералов в земной коре - около 3000.
Различие во внутреннем строении кристаллических и аморфных минералов вызывает и различия в их свойствах. Имеется несколько типов связей атомов, входящих в кристаллическую решетку соединения. Различают ионную (или электровалентную) и ковалентную химическую связь. В качестве примера типично ионной структуры можно привести кристаллы NaCl (рисунок 4). Это общий пример ионной связи. Ионная или электровалентная химическая связь возникает в результате взаимного притяжения разноименно заряженных ионов. Вещества подобного иона (гетерополярные) способны в большей или меньшей мере диссоциировать в водных растворах. 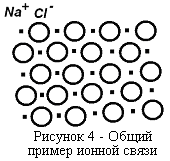 Ковалентная химическая связь создается в результате обобщения двух валентных элементов, принадлежащих атомам, между которыми возникает связь. Ковалентная связь существует в газах. Вещества с ковалентной связью (рисунок 5) не диссоциируют на ионы в водных растворах или вообще не растворяются. Иначе соединения с ковалентной связью называются гомеополярными соединениями.
Ковалентная химическая связь создается в результате обобщения двух валентных элементов, принадлежащих атомам, между которыми возникает связь. Ковалентная связь существует в газах. Вещества с ковалентной связью (рисунок 5) не диссоциируют на ионы в водных растворах или вообще не растворяются. Иначе соединения с ковалентной связью называются гомеополярными соединениями.
Форма связи может меняться в зависимости от температуры. Например, у поваренной соли с повышением температуры, особенно выше температур плавления (при переходе в парообразное состояние) ионная связь уступает место ковалентной. Вещества с сильной ковалентной связью относятся к числу легкокипящих веществ.
Кроме основных есть еще переходные типы связи. Например, химическая связь в кристаллической решетке сульфида занимает промежуточное положение между ионной и металлической связью.
Большое значение для определения прочности соединений имеют ионные радиусы элементов.
Энергия ионной решетки может быть выражена формулой: 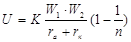 , где: К – постоянная, учитывающая тип кристаллической решетки и включающая число Авогадро; W1 и W2 – заряд ионов; rа и rк – радиусы аниона и катиона; n- величина, характеризующая силы отталкивания.
, где: К – постоянная, учитывающая тип кристаллической решетки и включающая число Авогадро; W1 и W2 – заряд ионов; rа и rк – радиусы аниона и катиона; n- величина, характеризующая силы отталкивания.
Чем меньше ионные радиусы, тем больше энергия решетки и прочнее соединение. Сравним относительную прочность LiF, NaF, KF, RbF,CsF. Анион во всех соединениях одинаков, радиус катиона увеличивается по ряду Li < Ne < K < Rb < Cs. Значит, энергия ионной решетки будет возрастать от лития к цезию. Ионные радиусы некоторых элементов близки или даже равны друг другу. Например, ионный радиус Nb+5 = 0.69 Å, Ta+5 = 0.69 Å, S2-= 0.3 Å, Se2- = 0.35 Å. В связи с такой близостью в размерах ионных радиусов возможно замещение одних элементов другими в химических соединениях.
Таблица 2 - Эффективные радиусы ионов (радиус, Å)
| I | II | III | IV | V | VI | VII |
| Cu – 0.96 Ag – 1.13 Au – 1.37 Li – 0.78 Na – 0.98 K – 1.33 Rb – 1.49 Cs – 1.65 | In – 0.83 Cd – 1.03 Hg – 1.12 Be – 0/34 Mg – 0.78 Ca – 1.06 Sr – 1.27 Ba – 1.43 | Ga – 0.62 In – 0.92 Tl – 1.05 B – 0.2 Al – 0.57 Sr – 0.83 Y – 1.06 La – 1.22 | Ge – 0.44 Sn – 0.74 Pb – 0.84 C – 0.2 Si – 0.39 Ti – 0.64 | N – 0.15 | Se – 0.35 Te – 0.56 O – 1.32 S – 1.79 | F - 1.33 Cl – 1.81 Br – 1.96 J – 2.2 |
Химическая активность элементов и форма присутствия этих элементов в природе. На основании данных по активностям (таблица 3) можно предварительно дать оценку устойчивых форм этих металлов в природе (таблица 4).
Таблица 3. Окислительно–восстановительные (электродные) потенциалы металлов (φ)
| Электродный потенциал в водном растворе при 25 оС, вольт | Электродный потенциал в эвтектическом расплаве LiCl-KCl при 450 оС, вольт | ||
| Сs = -3.02 | Co = -0.29 | Li = -3.41 | Sn = -1.082 |
| Li = -2.957 | Ni = -0.22 | Mg = -2,58 | Co = - 0.991 |
| К = -2.922 | Sn = -0.13 | Th(4) = -2.411 | Cu(l) = -0.85l |
| Ва = -2.90 | Pb = -0.22 | Hf(4) = -1.88 | Ni = -0.795 |
| Са = -2.87 | H2 = ±0.000 | Zr{4) = -1.86 | Cr (3) = -0.685 |
| Na = -2.712 | Sb = +0.10 | Mn (2) = -1.849 | Sb(3)=0.67 |
| Mg = -2.4 | Bi = +0.2 | Al = -1.797 | Bi (3) = -0.67 |
| Ti =-1.75 | As == +0.3 | Ti(3) = - 1.64 | Mo (3) = -0.638 |
| Al = -1.7 | Cu(2) = + 0,344 | Zn = -1.566 | As = -0.637 |
| Be = -1.69 | Cu(1) = +0.5l | Cr(2) = -1.425 | Hg(2) = -0.5 |
| U(4) = -1.4 | Hg = +0.798 | Cd = -1.316 | Fe(3) = -0.397 |
| Mn = -1.12 | Ag = +0.799 | U (4) = -1.19 | Rh (3) = -0.23 1 |
| Zn = -0.758 | Pd = + 0.820 | Fe (2) = -1.172 | Pt (3) = ±0.000 |
| Cr = -0.6 | Hg(l) = +0.86 | Pb = -1.101 | Au(l) = +0.311 |
| Fe (2) = -0.44 | Pt(4) = +0.863 |
Высокоактивные металлы, характеризующиеся высоким электродным потенциалом и высокими отрицательными значениями стандартной свободной энергии образования соединений, образуют в природе чаще всего простые соединения. Так, щелочные и щелочноземельные металлы образуют главным образом хлориды, карбонаты и сульфаты.
Металлы, расположенные в средней части таблицы активностей, часто присутствуют в рудах в виде силикатов. Некоторые из них - более активные - могут образовывать простые оксиды, а менее активные - ещё и сульфиды. Сульфиды в качестве промышленного минерала имеют значение для менее активных металлов.
Наименее активные металлы проявляют склонность к образованию селенидов, теллуридов, арсенидов и антимонидов или присутствовать в свободном состоянии
В природе образуется целый ряд разнообразных по физическим и химическим свойствам минералов. Однако в рудах полезные минералы присутствуют не в чистом виде, а смешанные с пустой породой. Причем чаще всего, содержание полезных компонентов в рудах очень невысокое. В задачу металлурга входит извлечь полезные металлы из руд в товарный металл.
Таблица 4 - Устойчивые формы и свойства металлов
| Металл | Электрохимический потенциал, В | Формы нахождения в природе и основные химические свойства |
| Li, Rb, Ca, K, Zn | (-3.01) - (-2.3) | Хлориды, карбонаты, сульфаты: легко окисляются на воздухе, образуют устойчивые оксиды, самопроизвольно реагирует с водой, образуют ионные соединения Sr, Na, La, Mg |
| Th, Ce, Ti, Be, Hf, Al, Zn, V | (-2,1) - (-1,44) | В основном оксиды, силикаты, сложные оксиды; окисляются при нагреве, образуют устойчивые оксиды, взаимодействуют с паром, образуют в основном ионные соединения |
| W, Mn, U, Se, Cr, Ga, Fe, Cd, In, Т1 | (-1.1) - (-0.335) | Простые и сложные оксиды и сульфиды, окисляется при значительном нагреве, образует оксиды средней прочности, оксиды менее активных металлов легковосстановимы, реагируют с паром. |
| Co, Ni, Мо, Sт, Zn, Pb, Sb, As, Bi, Te, Rh, Re, Hg, Ag, Cu | (-0.335) - (+0.799) | Образуют селениды, теллуриды и арсениды вместе с сульфидами и сложными оксидами; образует неустойчивые оксиды, некоторые из которых разлагаются при высокой температуре, не взаимодействуют с паром, во многих случаях проявляют сложные связи в соединениях |
| Sb, As, Bi, Cu, Te, Rh, Te, Rh, Pd, Ir, Pt, Au | (+0.1) - (+1.7) | Встречаются в форме сульфидов, теллуридов или в свободном состоянии; образуют неустойчивые оксиды, некоторые (Pd- Au) даже при комнатной температуре, не реагируют с паром и простыми кислотами, проявляет сложные связи в солях. |
Общая принципиальная схема металлургической переработки. Переработка руд включает обогащение и непосредственно металлургическую переработку.
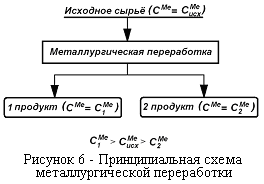
| Сущность металлургического процесса сводится к получению из исходного материала по крайней мере двух продуктов – более богатого и более бедного данным металлом (рисунок. 6), причем эти продукты должны быть получены в форме, допускающей их легкое разделение. |
Разделение продуктов переработки может происходить в следующих фазах.
1 Т + Т – относится к области обогащения.
2 Т + Ж – встречается в пиро- и гидрометаллургии. В гидрометаллургии – это процессы отстаивания и фильтрации. В пирометаллургии – это процессы ликвации.
3 Т + Г – встречается в пирометаллургических процессах, процессы возгонки, дистилляции.
4 Ж + Ж - встречается в пиро- и в гидрометаллургических процессах. В гидрометаллургии – это процессы жидкостной экстракции, в пирометаллургии – ликвации.
5 Т + Т – разделение твердых фаз относится к области обогащения.
6 Т + Ж – такое сочетание встречается в пиро- и гидрометаллургии. В гидрометаллургии – это процессы отстаивания и фильтрации. В пирометаллургии – это процессы ликвации.
7 Т + Г – встречается в пирометаллургических процессах, процессы возгонки, дистилляции.
8 Ж + Ж - встречается в пиро- и в гидрометаллургических процессах. В гидрометаллургии – это процессы жидкостной экстракции, в пирометаллургии – ликвации.
9 Ж + Г – система имеет значение в пиро и гидрометаллургии.
10 Г + Г – применяют для разделения адсорбцией, вымораживанием.
Различие в применении обогащения и металлургического передела состоит в том, что при обогащении переработка материала происходит без изменения его физических и химических свойств, при металлургическом переделе физические и химические свойства перерабатываемых материалов изменяются.
Основные методы металлургической переработки. Процессы, с помощью которых получают металлы, делят на пиро-, гидро- и электрометаллургические. К пирометаллургическим относятся все те процессы, которые протекают при высоких температурах («пир» - огонь, греч.). К гидрометаллургическим процессам относятся процессы, протекающие в водной среде. К электрометаллургическим процессам относят те, при которых металл восстанавливают из его соединений постоянным электрическим током.
Пирометаллургические процессы: ликвация, дистилляция, ректификация, транспортные процессы, окислительные процессы, восстановительные процессы, металлотермические процессы, сульфидные плавки, реакционная плавка, концентрационная плавка, обжиг (окислительный, сульфатизирующий, хлорирующий, восстановительный и т.д.), электротермические процессы и т.д.
Гидрометаллургические процессы: выщелачивание, осаждение металлов из растворов, экстракция, сорбция и т.д.
Электрометаллургические процессы: электролиз водных растворов, электролиз расплавленных солей, анодное окисление, цементация и т.д.
Поиск по сайту: