 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Структура ферментов
Ферменты (энзимы) – белки, являющиеся биологическими катализаторами. По строению могут быть простыми и сложными белками. Последние состоят из белковой части (апофермента) и небелковой части (кофермента). По отдельности каталитической активностью не обладают, активны лишь вместе. Существуют мультиферментные комплексы, состоящие из нескольких ферментов
Некоторые ферменты имеют четвертичную структуру – состоят из двух и более радикалов более мелких белков (субъединиц). Некоторые ферменты могут катализировать одну реакцию, но отличаться по строению субъединиц.
Их называют изоферментами. Например, креатинкиназа-1 мозга состоит из субъединиц ВВ, креатинкиназа-2 миокарда - из субъединиц ВМ, а креатинкиназа-3 скелетных мышц – из субъединиц ММ.
В молекуле фермента различают активый и аллостерический центры. К первому из них присоединяется вещество, на которое действует фермент (субстрат), происходит его превращение, образуется продукт реакции. Этот центр занимает лишь часть молекулы фермента. В его составе выделяют контактный участок, к которому присоединяется субстрат и каталитический центр, где происходит ферментативная реакция. В составе каталитического центра могут быть радикалы аминокислот, содержащие группы –СООН, -ОН, -NH2 и др., а у ферментов-сложных белков – и кофермент.
Аллостерический центр (allos – другой) – участок фермента, к которому присоединяются вещества, отличные от субстрата, способные изменять форму активного центра, ускоряя таким образом ферментативную реакцию (активаторы) или замедляя ее (ингибиторы). Такими веществами могут быть продукты собственной реакции, других реакций, гормоны и др.
Строение коферментов.
Различают коферменты витаминные т невитаминные.
Витаминные коферменты.. К ним относят никотинамидные, флавиновые, тиаминовые, пиридоксалевые, пантотеновые, кобаламиновые и другие коферменты.
Никотинамидные коферменты – производные витамина РР.
К ним относят никотинамидадениндинуклеотид (НАД) и никотинамидадениндинуклеотид фосфат (НАДФ). НАД из соединенных между собой остатков аденозинмонофосфата (АМФ) и никотинамидрибозилмонофосфата (НМФ). Он входит в состав ферментов дегидрогеназ, отщепляющих ионы водорода от гидроксильных, альдегидных или аминогрупп. Ионы водорода присоединяются к атому углерода никотинамида, находящемуся в четвертом положении. НАД способен переносить ионы водорода в дыхательную цепь митохондрий, где они окисляются с образованием АТФ.

НАДФ отличается по строению тем, что к второму углеродному атому радикала рибозы АМФ присоединяется остаток фосфорной кислоты. Является коферментом дегидрогеназ пентозного цикла, откуда ионы водорода поставляются в реакции биосинтеза различных веществ.
Флавиновые коферменты – производные витамина В2.
К ним относя флавинмононуклеотидд (ФМН) и флавинадениединуклеотид (ФАД). Первый из них входит в состав дыхательной цепи митохондрий. Он принимает ионы водорода и электроны от НАД-Н2 и передает их убихинону.

ФАД состоит из остатков АМФ и ФМН. Является коферментом дегидрогеназ, отщепляющих ионы водорода от янтарной кислоты и активированных жирных кислот. Ионы водорода присоединяются к атомам азота изоалаксозинового цикла и переносятся в дыхательную цепь митохондрий.
Тиаминовые коферменты – производные витамина В1. К ним относя тиаминдифосфат (ТДФ). Входит в состав транскетолазы пентозного цикла, а также ферментов отщепляющих углекислый газ от пировиноградной и альфа-кетоглутаровой кислот.
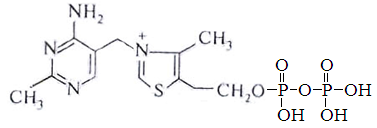
Пиридоксальфосфат (ПФ) – производное витамина В6. Входит в состав ферментов обмена аминокислот – декарбоксилаз, трансамназ.

Пантотеновые коферменты – производные витамина В3. К ним относят коэнзим А (КоА), входящий в состав ферментов, переносящих остатки уксусной, янтарной или жирных кислот.
СН3 ОН
!!
АДФ-О - СН2 - С----СН – СО – NH - СН2 -СН2 - COOH
!
СН3
Ко-А
Фолатные коферменты - производные витамина Вс (фолиевой кислоты).
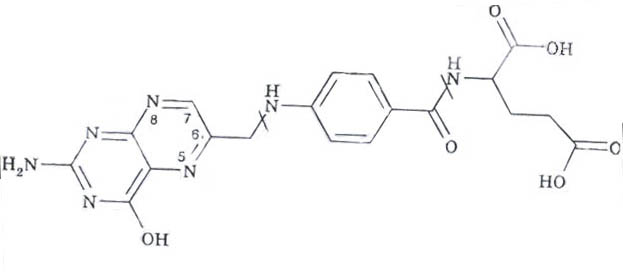
Участвуют в переносе метильных, альдегидных и других одноуглеродных фрагментов
Невитаминными коферментами могут быть гем (у каталазы, цитохромов и др. ферментов), ионы металлов (у глутатионпероксидазы, супероксиддисмутазы, амилазы и др.), глутатион (у глицеральдегид-3-фосфатдегидрогеназы), мононуклеотиды (АМФ, ГМФ, ЦМФ) и др.

Поиск по сайту: