 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Теория активных столкновений
Теория активных столкновений использует основные положения молекулярно - кинетической теории и предположение о существовании энергетического барьера. Для объяснения механизма химического взаимодействия в соответствии с этой теорией полагают, что молекулы реагентов - маленькие твердые шарики, находящиеся в беспрерывном хаотическом движении, средняя энергия которого определяется температурой системы. Столкновения молекул, обладающих энергией активации, являются эффективными и ведут к химическому превращению. Теория позволяет рассчитать число эффективных столкновений, а следовательно, и скорость химической реакции.
Для гомогенной реакции вида:
Н2(Г) + I2(Г) = 2НI(Г),
число двойных столкновений (Z) в 1 с в 1 м3 составит:
 , (10.27)
, (10.27)
где  и
и  - числа молекул Н2 и I2 в 1 м3;
- числа молекул Н2 и I2 в 1 м3;
k - постоянная Больцмана, равная 1,38 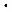 10-23 Дж/К;
10-23 Дж/К;
 - приведенная масса сталкивающихся молекул;
- приведенная масса сталкивающихся молекул;
 - сумма радиусов молекул.
- сумма радиусов молекул.
Если считать, что все двойные столкновения приводят к образованию конечного продукта, то есть Z = v, то при 700 К и р = 1,01 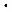 105 Па, Z = 1028. Это значило бы, что реакция состоялась бы за 10-10 с. Однако наблюдаемая скорость на много порядков меньше, то есть не каждое столкновение молекул приводит к осуществлению химической реакции.
105 Па, Z = 1028. Это значило бы, что реакция состоялась бы за 10-10 с. Однако наблюдаемая скорость на много порядков меньше, то есть не каждое столкновение молекул приводит к осуществлению химической реакции.
Можно допустить, что акт химического взаимодействия осуществляется лишь тогда, когда молекулы выгодно ориентированы в пространстве в момент столкновения. Это предположение может быть учтено введением стерического фактора или геометрической вероятности (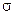 ).
).
Тогда v = 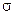
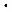 Z. Однако такой подход не согласуется с опытными данными.
Z. Однако такой подход не согласуется с опытными данными.
Во-первых, не может быть объяснена резкая температурная зависимость скорости реакции, вследствии того, что величина Z слабо изменяется с изменением температуры  .
.
Во-вторых, для согласования с экспериментальными данными величина 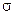 должна была бы составить значение 10-14
должна была бы составить значение 10-14 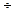 10-15, что трудно объяснимо.
10-15, что трудно объяснимо.
Следовательно, условием протекания акта химического превращения является не особое геометрическое расположение в пространстве сталкивающихся молекул, а их повышенный запас энергии. Другими словами реакция состоится, если энергия относительного давления молекул по линии их столкновения превысит некоторую критическую величину, то есть энергию активации.
Если  - доля молекул, обладающих энергией, не меньшей энергии активации Е, то скорость реакции вычислится из уравнения:
- доля молекул, обладающих энергией, не меньшей энергии активации Е, то скорость реакции вычислится из уравнения:
 , (10.28)
, (10.28)
где  (из закона распределения Максвелла - Больцмана).
(из закона распределения Максвелла - Больцмана).
Рассматриваемая реакция бимолекулярная, потому в соответствии с законом Гульдберга - Вааге
 . (10.29)
. (10.29)
Сравнение (10.28) и (10.29) дает:
 . (10.30)
. (10.30)
После интегрирования:
 , (10.31)
, (10.31)
где А - постоянная, включающая величины r, 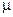 и
и 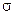 .
.
Сопоставляя (10.31) с уравнением Аррениуса (10.25) можно видеть, что теория активных столкновений в общем удовлетворительно объясняет наблюдаемую на опыте зависимость константы скорости реакции от температуры, так как величина 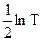 слабо зависит от температуры.
слабо зависит от температуры.
Поиск по сайту: