 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
XI. Гетерогенные процессы
Гетерогенными называются процессы, протекающие на поверхности раздела соприкасающихся фаз. К ним относятся химические процессы между веществами, находящимися в различных фазах, горение топлива, окисление металлов кислородом воздуха и многие физические процессы: растворение газов и твердых тел в жидкостях, кристаллизация чистых жидкостей и растворов и др.
Одна из особенностей гетерогенных процессов - зависимость их течения от размеров и состояния поверхности раздела фаз, а также от скорости их относительного движения.
Другая особенность состоит в многостадийности гетерогенных процессов. Кроме основного процесса - химической реакции, протекающей на самой поверхности раздела фаз, обязательны стадии подвода к этой поверхности исходных продуктов и отвод от нее конечных продуктов (стадии транспорта или массопереноса). Так как эти стадии последовательны, то скорость гетерогенного процесса определяется скоростью наиболее медленной стадии. Если определяющей стадией является сама химическая реакция, то говорят о кинетической области контроля процесса. Когда наиболее медленными стадиями являются стадии массопереноса путем диффузии, гетерогенный процесс считается протекающим в диффузионной области контроля.
Так как температура сильнее влияет на скорость химических процессов, чем на диффузию, то при изменении температуры гетерогенный процесс может перейти из кинетической области в диффузионную.
Диффузия, как один из способов массопереноса, имеет большое значение в гетерогенных процессах. Известны два закона диффузии.
Первый закон Фика утверждает, что масса вещества dm, переносимого диффузией в направлении некоторой оси x через перпендикулярную этому направлению площадку S за время 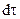 , пропорциональна градиенту концентраций
, пропорциональна градиенту концентраций  вдоль этого направления:
вдоль этого направления:
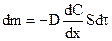 , (11.1)
, (11.1)
где D - коэффициент диффузии, м/с2.
Знак “минус” в (11.1) показывает, что диффузия направлена в сторону уменьшения концентрации.
На основании (11.1) можно установить скорость диффузии:
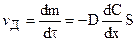 , (11.2)
, (11.2)
Зависимость концентрации от времени для фиксированного сечения устанавливается вторым законом Фика:
 (11.3)
(11.3)
Диффузия имеет стационарный характер, когда концентрация изменяется только с расстоянием, а от времени не зависит:
 ,
,
тогда
 .
.
После интегрирования:
С = С0 + ax, (11.4)
где С0 соответствует координате x = 0.
Из (11.4) следует, что при стационарной диффузии концентрация линейно изменяется вдоль направления диффузии, а градиент концентраций записывается с помощью конечных величин:
 , (11.5)
, (11.5)
где  - конечное значение x.
- конечное значение x.
Подставляя (11.5) в уравнение (11.2), можно определить скорость стационарной диффузии:
 . (11.6)
. (11.6)
Иногда эту формулу записывают так:
 , (11.7)
, (11.7)
где  - коэффициент массопередачи.
- коэффициент массопередачи.
Пусть гетерогенная реакция, включающая химическую реакцию первого порядка и протекающая стационарно, имеет лишь две последовательные стадии: собственно химическую реакцию и процесс диффузии, которым обеспечивается транспорт реагентов в зону химической реакции. Причем отвод конечных продуктов реакции осуществляется очень быстро и его можно не учитывать.
Вследствие стационарности данного процесса на поверхности раздела фаз не происходит накопления исходных или конечных продуктов, поэтому скорости обеих стадий одинаковы. Из условия стационарности  следует:
следует:
 . (11.8)
. (11.8)
Тогда скорость реакции вычислится:
 ,
,
или
 ,
,
где  - диффузионное сопротивление;
- диффузионное сопротивление;
 - химическое сопротивление.
- химическое сопротивление.
Если k >>  , то скорость гетерогенной реакции равна
, то скорость гетерогенной реакции равна  и определяется лишь величиной
и определяется лишь величиной  , характеризующей диффузию. Процесс протекает в диффузионной области контроля. Для случая
, характеризующей диффузию. Процесс протекает в диффузионной области контроля. Для случая  >> k
>> k 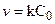 и суммарный процесс определяется химической стадией и протекает в кинетической области.
и суммарный процесс определяется химической стадией и протекает в кинетической области.
Более общим является влияние на скорость суммарного процесса обеих рассматриваемых стадий, роль которых зависит от особенностей реакции и внешних условий. Так, при понижении температуры и перемешивании влияние диффузии понижается.
Поиск по сайту: