 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Повышение энергетической эффективности химического производства
Энергетическая ценность источников энергии определяется количеством энергии (кВт ∙ ч), которая может быть получена при сжигании 1 кг или 1 м3 топлива. Энергетическая ценность некоторых видов топлива приведена ниже (для природного газа – в кВт ∙ ч/м3, для остальных – в кВт ∙ ч/кг):
| каменный уголь | − | 8,0 кВт ∙ ч/кг; |
| кокс | − | 7,2 кВт ∙ ч/кг; |
| торф | − | 4,0 кВт ∙ ч/кг; |
| коксовый газ | − | 4,8 кВт ∙ ч/м3; |
| природный газ | − | 10,8 кВт ∙ ч/м3; |
| уран | − | 22,5 ∙ 106 кВт ∙ ч/кг. |
Целесообразность применения некоторых источников энергии определяется не только их энергетической ценностью, но и запасами их в природе, географическим положением, доступностью и некоторыми другими факторами.
Состав энергетических потоков в ХТС показан на рис. 5.
Q топл Q прод. цел
Q эл Q прод. поб
Q сыр ХТС Q эн
Q мат Q энд
Q экз Q пот
Рис. 5. Состав энергетических потоков ХТС
Источниками энергии являются входящие потоки, несущие энергию топлива Q топл, электроэнергию Q эл, теплосырья Q сыр и вспомогательных материалов Q мат, а также экзотермические реакции Q экз. Их суммарное количество – потребление, или затраты энергии Q затр. Из системы энергия выводится с потоками целевых продуктов Q прод. цел и побочных продуктов Q прод. поб, с энергетическими потоками Q эн, затрачивается на проведение эндотермических реакций Q энд и теряется естественным путем Q пот. Из выходящих энергетических потоков полезно используется Q эн в виде пара котлов-утилизаторов, нагреваемых в теплообменниках-утилизаторах внешних потоков (например, воды), энергии турбин и электрогенераторов.
Энергетическую эффективность ХТС характеризуют тепловым коэффициентом полезного действия – тепловым КПД
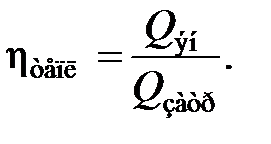
Более рационально коэффициент полезного действия может быть представлен отношением полезно затраченной теплоты к суммарному ее количеству, введенному в химико-технологическую систему:

где Q п – теплота, полезно затраченная на технологические цели и определяемая из условий теоретического расхода для осуществления физических и химических процессов, имеющих место в элементах ХТС; α – доля теплоты вторичных энергоресурсов, генерированных в элементах ХТС (котлах-утилизаторах) и расходуемых вне и внутри системы; Q вэр – теплота вторичных энергетических ресурсов, генерированная в энергетическом элементе ХТС; В – расход топлива на технологические цели ХТС; Q т – теплота сгорания топлива; Q экз – теплота, образуемая при химических и физических превращениях в ХТС; Q н – теплота, подведенная в ХТС с энергоносителями (водяной пар, горячая вода и др.).
Энергоемкость химического производства (расход энергии на единицу получаемой продукции) – один из важнейших показателей эффективности химического производства.
Концепция полного использования энергетических ресурсов направлена на минимизацию затрат на энергетические и тепловые ресурсы, максимально возможное их использование в процессе по следующим направлениям [1, 5, 7].
Регенерация теплоты и энергии. В ряде случаев для проведения процесса необходимо нагреть поток, а затем – охладить. Это можно сделать рационально: нагреть входящий поток теплотой выходящего. Наиболее результативным будет достижение такого решения в случае протекания экзотермической реакции. Подобные схемы регенерации теплоты широко распространены в промышленности. На рис. 6 представлена схема гидродеалкилирования толуола с максимальной регенерацией теплоты. Выходящие из реактора горячие газы используются в кипятильниках колонн разделения и предварительного подогрева реакционной смеси.

Рис. 6. Схема гидродеалкилирования толуола с максимальной регенерацией теплоты:
1 – печь; 2 – реактор; 3 – толуольная колонна; 4 – стабилизирующая колонна;
5 – бензольная колонна; 6 – разделитель фаз; 7 – компрессор
Регенерированная в виде пара в котле-утилизаторе теплота может быть затем использована как энергоноситель для привода паровых турбин этого же производства (рис. 7) или как теплоноситель в технологических целях в этом же производстве.
Вход
ПТ К
Д
ХТП
Выход
КУ
Пар
Рис. 7. Схема регенерации теплоты с дополнительным
приводом компрессора от паровой турбины:
К – компрессор; Д – основной электрический привод;
ПТ – паровая турбина; КУ – котел-утилизатор;
ХТП – химико-технологический процесс
Регенерацию энергии осуществляют в процессах под давлением. Исходный газ сжимается в компрессоре и направляется в технологические аппараты. Отработанный сжатый газ поступает в турбину, находящуюся на одном валу с компрессором (рис. 8). При этом расходы на энергию для привода компрессора будут значительно уменьшены.
Вход Выход
К ГТ
Д
ХТП
Рис. 8. Схема регенерации энергии с дополнительным
приводом компрессора от газовой турбины:
К – компрессор; Д – основной электрический привод;
ГТ – газовая турбина; ХТП – химико-технологический процесс
Утилизация теплоты и энергии заключается в использовании теплоты (энергии) потока для выработки тепловых (пар, горячая вода), электрических и других энергетических ресурсов, применяемых не в самом производстве. Бóльшая часть энергии химического производства, используемая для обеспечения химико-технологического процесса, остается в виде энергии технологических потоков, остальная часть потребляется на осуществление эндотермических процессов и теряется в окружающей среде.
С другой стороны, в ходе протекания экзотермических процессов (реакций) энергия может также выделяться. Таким образом, оставшуюся и выработанную энергию можно применять, получая, например, пар в котлах-утилизаторах, а энергию давления используя для привода электрогенератора. Такие потоки, обладающие определенной энергией, являются вторичными энергетическими ресурсами. Они играют значительную роль в промышленном производстве.
Альтернативные источники энергии. Помимо традиционно используемых источников энергии (пар, горячие теплоносители, электроэнергия), вырабатываемых при потреблении топливных ресурсов, в последнее время перспективу развития получают легко возобновляемые и более дешевые источники, такие как теплота атомных котлов (несмотря на современную тенденцию к радиофобии), солнечная энергия и др. Конечно, их применение очень специфично, но в ряде случаев это может реально привести к уменьшению расхода более дефицитных и дорогих топливных ресурсов.
Замена химической схемы получения продукта при переходе к процессу с меньшим числом стадий, как правило, сокращает число циклов нагрева и охлаждения потоков и уменьшает затраты на преодоление гидравлического сопротивления. Это можно проследить на примере производства 1,3-бутадиена (дивинила СН2=СН–СН=СН2). В сложившейся технологии получения этого мономера превалирует способ двухстадийного дегидрирования бутана
СН3–СН2–СН2–СН3  СН3–СН2–СН=СН2
СН3–СН2–СН=СН2 
 СН2=СН–СН=СН2
СН2=СН–СН=СН2
На обеих стадиях процесса (получение бутилена и дивинила) протекают эндотермические каталитические реакции дегидрирования, сопровождающиеся увеличением объема. Функциональная схема двухстадийного получения 1,3-бутадиена приведена на рис. 9, а. Этот метод отличается сравнительно высоким выходом целевого мономера (65%), но имеет ряд недостатков, к которым относятся необходимость разделения газовых смесей после каждой ступени, повышенные капитальные вложения и энергетические затраты.
В промышленности реализована альтернативная схема синтеза 1,3-бутадиена одностадийным дегидрированием н -бутана. При одностадийном процессе указанные реакции одновременно протекают на катализаторе, который довольно быстро дезактивируется откладываемыми на его поверхности углистыми отложениями. Активация (регенерация) катализатора возможна путем выжигания отложений. Дегидрирование осуществляется под вакуумом (0,05−0,06 МПа) при температуре 580−600ºС в адиабатических реакторах регенеративного типа, в которых циклы дегидрирования и регенерации катализатора чередуются. Соответственно, дегидрирование проходит последовательно в разных реакторах. Схема процесса представлена на рис. 9, б. Рабочий цикл катализатора очень короткий (несколько минут). Теплота, выделяемая при регенерации катализатора, аккумулируется в нем и используется в цикле дегидрирования. Это экономит теплоту при выходе на рабочий цикл и его поддержание. Условием эффективной работы реакторов подобного типа является сбалансированность теплот реакции и регенерации. В зависимости от мощности производства число циклически работающих реакторов в установке составляет 5−8 аппаратов. Более короткая технологическая схема и сбалансированность теплот отдельных стадий процесса значительно сокращают затраты тепла и энергии.
Другой пример. Винилхлорид получают в две стадии – оксихлорированием этилена и последующим дегидрохлорированием образующегося дихлорэтана. Первая реакция – экзотермическая, вторая – эндотермическая. Подбором бифункционального катализатора удалось провести оба процесса в одном реакторе по следующей химической схеме:
1. С2Н4 + 2HCl + 0,5O2 = C2H4Cl2 + H2O + Q 1
2. 2C2H4Cl2 = C2H3Cl + 2HCl – Q 2
Очевидна экономия энергии. Кроме того, выделяющийся хлористый водород полностью связывается в реакции оксихлорирования (сбалансированный по хлору процесс).
| Бутановая фракция | н -Бутан | Бутеновая фракция Бутан-бутеновая фракция | н -Бутан | |||
| Дегидрирование в бутены | Дегидрирование | |||||
| Контактный газ | ||||||
| Выделение бутан- бутеновой фракции | Выделение фракции С4 | |||||
| Бутан-бутеновая фракция | Фракция С4 | |||||
| Разделение | Разделение | |||||
| Бутеновая фракция | 1,3-бутадиен | |||||
| Дегидрирование в бутадиен | Очистка | |||||
| Контактный газ | 1,3-бутадиен | |||||
| Выделение бутен- бутадиеновой фракции | ||||||
| Бутен- бутадиеновая фракция | ||||||
| Выделение и очистка 1,3-бутадиена | ||||||
| 1,3-бутадиен | ||||||
а б
Рис. 9. Схемы дегидрирования н -бутана в дивинил (1,3-бутадиен):
а – двухстадийное дегидрирование; б – одностадийное дегидрирование
Поиск по сайту: