 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Задача № 3
Магний массой 6,08 г сожгли в кислороде. При этом выделилось
150,5 кДж теплоты. Определите энтальпию образования оксида магния, запишите термохимическое и термодинамическое уравнения.
Решение:
1. Запишем химическое уравнение реакции горения магния:
2Mg + O2 = 2MgO.
2. Находим количество вещества магния:
n (Mg) =  ; n (Mg) =
; n (Mg) = 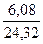 = 0,25 моль.
= 0,25 моль.
3. Для определения энтальпии образования оксида магния необходимо рассчитать количество теплоты, которое выделяется при сгорании
1 моль магния, а, следовательно, при образовании 1 моль оксида магния:
Q =  кДж/моль.
кДж/моль.
Теплота реакции равна энтальпии с обратным знаком D Н обр(MgO)= – Q.
4. Запишем термохимическое и термодинамическое уравнения данной реакции:
Mg (к) + 1/2О2 (г) = MgO(к) +602 кДж/моль;
Mg (к) + 1/2О2 (г) = MgO(к), D Н° = –602 кДж/моль.
Ответ: D Н° обр(MgO)(к) = –602 кДж/моль.
Упражнения и задачи для самостоятельного решения
1. По каждой из возможных классификаций определите типы реакций:
а) N2(г) + 3Н2(г) 2NH3(г), DНо = – 92 кДж
б) N2(г) + О2(г) 2NO(г) – 180 кДж
в) 2SO2(г) + О2(г) 2SO3(г), DН < 0
г) Н2(г) + Сl2(г) 2HCl + 184,5 кДж.
2. При сгорании 1 г серы выделяется 9,3 кДж тепла. Составьте термохимическое уравнение горения серы до оксида серы(IV) и рассчитайте стандартную теплоту образования оксида серы(IV).
(Ответ: –297,6 кДж)
3. Исходя из термохимического уравнения реакции горения угля
С + О2 ® СО2+394 кДж, сосчитайте сколько теплоты выделится при образовании 220 г оксида углерода(IV). (Ответ: –1970 кДж)
4. Сколько теплоты выделится при участии в реакции 14,2 г хлора по уравнению: Н2 + Сl2 = 2НСl + 184,5 кДж? (Ответ: 36,9 кДж)
5. При сжигании 3,6 г алюминия в кислороде выделяется 111,3 кДж теплоты. Вычислите стандартную теплоту образования оксида алюминия из простых веществ. (Ответ: –1661 кДж)
6. Сколько кДж теплоты выделится при сгорании1120 г оксида углерода(II) по уравнению: СО(г) + 1/2О2(г) = СО2(г) + 283 кДж?
(Ответ: –11320 кДж)
7. По термохимическому уравнению 2Na+Cl2 = 2NaCl + 822 кДж, рассчитайте объем вступившего в реакцию хлора (н.у.), если выделилось 2055 кДж теплоты. (Ответ: 56 л)
 Дополнительные задания
Дополнительные задания
1. По термохимическому уравнению С+О2=СО2+401 кДж вычислите, сколько теплоты выделится при сжигании 1 кг антрацита, в котором массовая доля негорючих примесей 4%. (Ответ: 3,2×104 кДж)
2. Какой объем метана (СН4) надо сжечь, чтобы выделившейся теплоты хватило для получения 440 г оксида углерода(IV) из карбоната кальция? Реакции протекают по уравнениям:
СН4(г)+2О2(г)=СО2(г)+2Н2О(пар)+982 кДж;
СаСО3(тв)=СаО(тв)+СО2(г)–180 кДж. (Ответ: 41 л)
3. При сжигании 1,2 г магния в кислороде выделилось 30,1 кДж теплоты. Вычислите тепловой эффект и напишите термохимическое уравнение реакции горения магния в кислороде. (Ответ: 1204 кДж)
4. Исходя из термохимического уравнения 2Mg+O2 = 2MgO + 1200 кДж, рассчитайте, сколько сгорело магния, если выделилось 900 кДж теплоты. (Ответ: 36 г)
5. Определите, сколько теплоты выделится при взаимодействии 40,5 г ZnO с избытком алюминия по термохимическому уравнению:
3ZnO + 2Al = 3Zn + Al2O3 + 624 кДж). (Ответ: 104 кДж)
6. При образовании 1 моль CuO из простых веществ выделяется
154,5 кДж теплоты. Сколько выделится теплоты при образовании 320 г CuO? (Ответ: 618 кДж)
Поиск по сайту: