 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Алгоритм расчета температуры горения
1. Рассчитать суммарный объем продуктов горения и отдельно объем каждого компонента продуктов горения.
VПГпр = V(CO2) + V(H2O) + V(N2) + V(SO2) + DVвозд
Расчет объема продуктов горения выполняется в зависимости от характера горючего вещества (индивидуальное вещество, смесь газов или вещество сложного элементного состава). Методика расчета приведена в примерах 2.8, 2.9, и 2.10.
Для индивидуальных веществ можно также определять количество продуктов горения в молях (коэффициенты в уравнении реакции горения).
2. Рассчитать низшую теплоту сгорания вещества.
Для индивидуальных веществ расчет выполняется по I следствию закона Гесса (при наличии табличных значений энтальпий образования).
По формуле Д.И. Менделеева (3.3) расчет Qн может быть выполнен как для веществ с известным элементным составом, так и для индивидуальных веществ.
Для газовых смесей Qн рассчитывается по формулам (3.4) и (3.5).
3. Если по условию задачи есть теплопотери (h), то рассчитывается количество тепла, пошедшего на нагрев продуктов горения QПГ
QПГ = Qн (1 – h), кДж/кг или кДж/м3(3.9)
4. Находим среднее теплосодержание продуктов горения Qср
при отсутствии теплопотерь (h)
Qср =  , кДж/м3 (3.10)
, кДж/м3 (3.10)
при наличии теплопотерь
Qср =  , кДж/м3 (3.11)
, кДж/м3 (3.11)
5. По значению Qср с помощью таблиц приложений 3 и 4 (“Теплосодержание газов при постоянном давлении”), ориентируясь на азот, приближенно определяем температуру горения Т1.
При подборе температуры горения ориентируются на азот, т.к. в большей степени продукты горения состоят именно из азота. Однако, поскольку теплосодержание углекислого газа и паров воды выше, чем у азота, то их присутствие в продуктах горения несколько понижает температуру горения, поэтому ее нужно принимать несколько ниже (на 100-2000С), чем по азоту.
6. Рассчитываем теплосодержание продуктов горения при выбранной температуре Т1:
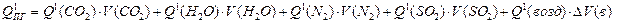 (3.12)
(3.12)
где
Q1(CO2), Q1(H2O), Q1(N2), Q1(SO2), Q1(возд) – табличные значения теплосодержания газов
при выбранной температуре Т1.
7. Сравниваем Q1ПГ с Qн или QПГ, рассчитанных по п.2 или п.3.
Если Q1ПГ < Qн (QПГ), то выбираем температуруТ2 > Т1 на 1000С;
если Q1ПГ > Qн (QПГ), то выбираем температуруТ2 < Т1 на 1000С.
8. Повторяем расчет теплосодержания продуктов горения при новой температуре Т2:

9. Расчет проводим до получения неравенства:
Q1ПГ < Qн (QПГ) < Q2ПГ, где
Q1ПГ и Q2ПГ – теплосодержание продуктов горения при температурах Т1 и Т2,
отличающихся на 1000С.
10. Интерполяцией определяем температуру горения ТГ:
ТГ = Т1 +  (3.13)
(3.13)
Если потери тепла не учитывались, то получаем адиабатическую температуру горения, а если учитывались, то - действительную температуру горения вещества.
| Расчет действительной температуры горения индивидуального вещества | Пример 3.4. Вычислить действительную температуру горения анилина С6Н5NH2, если потери тепла излучением составляют 20 %, а горение протекает с коэффициентом избытка воздуха 1,1. |
1. Составляем уравнение реакции горения анилина:
С6Н5NH2 + 7,75(O2 + 3,76 N2) = 6 CO2 + 3,5 H2O + 7,75×3,76 N2 + 0,5 N2
По уравнению реакции горения определяем число моль продуктов горения и число моль избытка воздуха:
nвтеор = 7,75 × 4,76 = 36,89 моль
Dnв = nвтеор (a –1) = 36,89 (1,1 – 1) = 3,689 моль
nпгпр = n(СО2)+n(Н2О) n(N2)+n(DVв) = 6 + 3,5 + 7,75×3,76 + 0,5 + 3,689 = 42,829 моль
2. Теплота горения анилина по справочным данным составляет
Qгор = 3484, кДж/моль = 3484000 Дж/моль
3. По условию задачи теплопотери составляют 20 %, следовательно, h = 0,2.
QПГ = 3484000 (1 – 0,2) = 2787200 Дж/моль
4. Определяем среднее теплосодержание продуктов горения:
Qср =  65077,4 Дж
65077,4 Дж
5. По таблице приложения 3, ориентируясь на азот, определяем Т1 = 18000С
6. Рассчитываем теплосодержание продуктов горения при 18000С.
QПГ1800 = 96579,5×6 + 77598,8×3,5 + 59539,9×7,75×3,76 + 66000×3,689 = 2859312,7 Дж
7. QПГ1800 = 2859312,7 > QПГ = 2787200, следовательно, выбираем Т2 = 17000С
8. Рассчитываем теплосодержание продуктов горения при 17000С.
QПГ1700 = 90545,9×6 + 72445,1×3,5 + 55936,5×7,75×3,76 + 56397,4×3,689=2662844,5 Дж
QПГ1700 = 2662844,5 < QПГ = 2787200, следовательно температура горения находится в интервале от 1700 до 18000С.
9. Рассчитываем температуру горения:
ТГ =1700 + 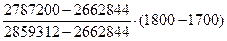 = 17630С = 2036 К
= 17630С = 2036 К
| Расчет действительной температуры горения сложного вещества с известным элементным составом | Пример 3.5. Вычислить действительную температуру горения горючего сланца следующего состава: С – 35 %, Н – 5 %, О – 10 %, S – 4 %, N – 1 %, W – 15 %, зола – 30 %. Потери тепла излучением составляют 10 %, а горение протекает с коэффициентом избытка воздуха 1,2. Условия нормальные. |
1. По формулам (2.9) – (2.12) определяем объем каждого компонента продуктов горения 1 кг горючего сланца.
V(СО2) =  = 0,651 м3
= 0,651 м3
V(H2O) =  = 0,746 м3
= 0,746 м3
V(SО2) = 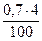 = 0,028 м3
= 0,028 м3
V(N2) =  = 3,455 м3
= 3,455 м3
VПГ = 0,651 + 0,746 + 0,028 + 3,455 = 4,88 м3
2. Горение протекает с коэффициентом избытка воздуха 1,2, следовательно, в состав продуктов горения будет входить избыточный воздух.
По формуле (3.8) определяем теоретический объем воздуха, необходимый для горения данной массы образца угля:
Vвтеор = 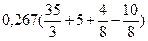 = 4,28 м3
= 4,28 м3
Избыток воздуха определим по формуле (2.4):
DVв= Vвтеор(a -1) = 4,28×(1,2 – 1) = 0,856 м3
С учетом избытка воздуха практический объем продуктов горения составит:
VПГ* = VПГ + DVв = 4,88 + 0,856 = 5,736 м3
3. Рассчитываем Qн по формуле Д.И. Менделеева.
Qн = 339,4×35 + 1257×5 – 108,9×(10 + 1 – 4) – 25,1×(9×5 + 15) = 15881,7 кДж/кг
4. С учетом теплопотерь определяем теплосодержание продуктов горения:
QПГ = 15881,7 (1,1 – 1) = 14293,53 кДж/кг
5. Определяем среднее теплосодержание продуктов горения:
Qср =  2480,22 кДж/м3
2480,22 кДж/м3
По таблице приложения 4, ориентируясь на азот, определяем Т1 = 15000С.
6. Определяем теплосодержание продуктов горения при 15000С:
QПГ1500 = 3505,7×0,651 + 2781,3×0,746 + 2176,7×3,455 + 3488,2×0,028 + 2194,7×0,856 = 13853,889 кДж
7. QПГ1500 = 13853,889 < QПГ = 14293,53, следовательно, выбираем Т2 = 16000С.
8. Определяем теплосодержание продуктов горения при 16000С:
QПГ1600 = 3771,4×0,651 + 3004,2×0,746 + 2335,5×3,455 + 3747,5×0,028 + 2355,2×0,856 = 14886,44 кДж
9. QПГ1600= 14886,44 > QПГ = 14293,53, следовательно, температура горения вещества находится в интервале от 1500 до 16000С.
10. Определяем температуру горения:
ТГ =1500 +  = 15560С = 1829 К
= 15560С = 1829 К
Поиск по сайту: