 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ХІ.5. Необоротні реакції другого, третього та n-го порядків
Швидкість реакції другого порядку визначається рівнянням:
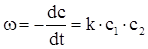 , (ХІ.5.1)
, (ХІ.5.1)
або коли реагенти мають однакові концентрації, кінетичне рівняння має вигляд
 (ХI.5.2)
(ХI.5.2)
Кінетичне рівняння для реакцій другого порядку виведемо на прикладі реакції
А + В = D + R
Нехай у момент часу t = 0 концентрації речовин А і В відповідно рівні а і b. Припустимо, що до моменту часу t в одиниці об’єму прореагує х молей А і, відповідно, х молей В. Тоді на цей час залишаться непрореагованими (а - х) молей А і (b - х) молей В, і швидкість реакції визначатиметься за таким рівнянням:
 (ХІ.5.3)
(ХІ.5.3)
Інтегрування диференціального рівняння (ХІ.5.3) з урахуванням початкових умов (t = 0, х = 0) дає
 , (ХІ.5.4)
, (ХІ.5.4)
де k має розмірність: [k] = t-1 моль-1.
Якщо вихідні концентрації речовин А і В рівні, тобто а = b, то диференційне рівняння швидкості записується так:
 (ХІ.5.5)
(ХІ.5.5)
Розділивши змінні в цьому рівнянні і проінтегрувавши його в межах від 0 до t і від 0 до х, одержимо
 . (ХІ.5.6)
. (ХІ.5.6)
Якщо прореагує половина вихідної речовини, тобто коли х = а /2, тоді  . Після того, як замінимо значення х в (ХІ.5.6) це рівняння прийме вигляд
. Після того, як замінимо значення х в (ХІ.5.6) це рівняння прийме вигляд
 , (ХІ.5.7)
, (ХІ.5.7)
тобто час напіврозпаду для реакцій другого порядку обернено пропорційний кількості концентрації вихідної речовини. Таким чином час розпаду для гомогенних реакцій, що протікають у розчині, залежить від концентрації, а в газовому середовищі - від тиску. Слід також враховувати, що константи швидкості реакцій різного порядку мають різну розмірність, і співставляння їх абсолютних значень позбавлено фізичного змісту.
Приклад реакції другого порядку в розчині - омилення складного ефіру лугом:
СН3СООС2Н5 + NаОН ® СН3СООNа + С2Н5ОН
Кінетика реакцій третього порядку: 3А ® ¼; або 2А + В ® ¼; або А + В + С ® ¼ при рівних початкових концентраціях реагуючих речовин описується рівнянням:
 , (ХІ.5.8)
, (ХІ.5.8)
 , (ХІ.5.9)
, (ХІ.5.9)

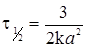 (ХІ.5.10)
(ХІ.5.10)
В загальному випадку для реакцій n-го порядку
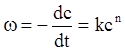 ; (ХІ.5.11).
; (ХІ.5.11).
 ; (ХІ.5.12)
; (ХІ.5.12)
 . (ХІ.5.13)
. (ХІ.5.13)
Неважко помітити, що час повного перетворення (t100 %) для реакції першого і більш високих порядків теоретично рівні безкінечності.
Поиск по сайту: