 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ХІ.13. Мономолекулярні реакції
Реакції мономолекулярного типу більш важкі для теоретичного дослідження, ніж бімолекулярні процеси. В останніх необхідною умовою хімічного перетворення є зіткнення двох молекул. У мономолекулярних реакціях частинки вихідної речовини з невідомих причин зазнають перетворення, причому, незрозуміло, в чому полягає відмінність між молекулою, що зазнає перетворення, і другою, яка ще не вступила в реакцію. Причину активації молекул Ліндеман вбачав у зіткненнях, які активують молекули. Таким чином, у цій теорії мономолекулярні реакції розглядаються як бімолекулярні. Швидкість, з якою утворюються при зіткненнях активні частинки, повинна рівнятись швидкості реакції плюс швидкість процесу дезактивації. Передбачається, що якщо активована молекула не вступила в реакцію, то внаслідок наступних зіткнень вона губить надлишкову енергію і переходить зі збудженого в нормальний стан. До таких реакцій відносять розклад N2O5, піроліз вуглеводнів, розклад аліфатичних галоген похідних, розклад органічних оксигено- та нітрогеновмісних сполук тощо.
Позначимо звичайні молекули А, а активовані А*. Тоді на підставі вищесказаного можна написати рівняння:
k1 [А]2 = k2 [А][А*] + k3[А*], (ХІ.13.1)
де k1, k2, k3 - константи швидкості для процесу активації, дезактивації і реакції. З рівняння (ХІ.13.1) знаходимо концентрацію активних молекул:
 (ХІ.13.2)
(ХІ.13.2)
Підставляючи цю величину в рівняння для швидкості реакції, знаходимо:
 (ХІ.13.3)
(ХІ.13.3)
Якщо реакція протікає при високому тиску, то зіткнення між молекулами здійснюються дуже часто, і більшість активних частинок встигають втратити надлишкову енергію раніше, ніж відбудеться хімічне перетворення. В цьому випадку рівняння (ХІ.13.3) приймає вигляд:
 (ХІ.13.4)
(ХІ.13.4)
Другий крайній випадок відповідає низькому тиску. При цьому час між двома зіткненнями може зробитись настільки значним, що більшість збуджених молекул встигає прореагувати до того моменту, коли вони відчують зіткнення, що веде до дезактивації. Тоді реакція буде протікати за рівнянням:
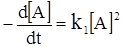 . (ХІ.13.5)
. (ХІ.13.5)
Отже, високі тиски відповідають реакції першого порядку, а низькі тиски відповідають другому порядку. Для ряду газових реакцій схема, що запропонована Ліндеманом, одержала експериментальне підтвердження. Проте є велике число реакцій, які не вкладаються в рамки цієї простої схеми. Були запропоновані інші пояснення причин мономолекулярних реакцій, засновані на аналізі розподілу енергії між атомами, що утворюють дану молекулу.
Молекула розглядається як сукупність частинок, що знаходяться в коливальному стані, тобто як сукупність осциляторів. Спочатку передбачалось, що для реакції необхідна повна енергія у всіх осциляторів, іншими словами, молекула робиться реакційно здатною, коли на всіх коливальних ступенях свободи зосереджується повна критична енергія. На підставі цих припущень Гіншельвуд вивів рівняння для числа активних молекул:
 , (ХІ.13.6)
, (ХІ.13.6)
де s означає число ступенів свободи молекули.
Практична перевірка цього рівняння показала, що в ряді випадків врахування всіх коливальних ступенів свободи дає ненормально велике значення швидкості. Вдосконалення теорії Гіншельвуда було зроблено Касселем і Слетером. Характерною особливістю їх поглядів є гіпотеза про те, що для хімічного перетворення не потрібна активація всіх ступенів свободи. В активації беруть участь лише зв’язки, що безпосередньо вступають у хімічне перетворення. Тому необхідно обчислювати імовірність того, що потрібна енергія зосередиться на певному осциляторі. Згідно зі Слетером, перерозподіл між атомами відбувається лише в момент зіткнення. Теорія Касселя і Слетера дозволила одержати краще погодження з дослідом, однак і вони допускають певне довільне трактування при аналізі питання про підбір числа коливальних ступенів свободи.
Поиск по сайту: