 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
XIV. 4. Типи електродів
В електрохімії електродом називають як електрохімічну систему, що включає метал і розчин електроліту, так і власне метал (або напівпровідник). З точки зору електродної реакції електрод – це система метал – розчин електроліту, в якій відбувається або безпосередній обмін зарядженими частинками, або обмін через ряд проміжних фаз; швидкість обміну може бути самою різною.
Електроди в залежності від влаштування і типу електродної реакції ділять на електроди першого і другого роду і окисно – відновні або редокс – електроди.
Металеві електроди, що занурені у водний розчин солі цього ж металу, є електродами першого роду. На таких електродах в залежності від знаку ЕРС ланцюга, в який включений електрод, протікає процес переходу катіона з металу в розчин або із розчину в метал. Потенціал такого електроду визначається за рівнянням Нернста.
До електродів першого роду часто відносять амальгамні електроди, які відрізняються тим, що в них замість чистого металу використовують розчин даного металу в ртуті (амальгама), що знаходиться в контакті з розчином, який містить іони цього металу.
 Наприклад, в кадмієвому амальгамному електроді Cd2+│Cd, Hg протікає реакція Cd2+ + 2ē Cd (Hg). Його потенціал залежить не стільки від активності іонів Cd2+ в розчині, стільки від активності Cd в амальгамі а Cd(Hg). Рівняння для визначення потенціалу такого електроду записується так:
Наприклад, в кадмієвому амальгамному електроді Cd2+│Cd, Hg протікає реакція Cd2+ + 2ē Cd (Hg). Його потенціал залежить не стільки від активності іонів Cd2+ в розчині, стільки від активності Cd в амальгамі а Cd(Hg). Рівняння для визначення потенціалу такого електроду записується так:
 (XIV.4.1)
(XIV.4.1)
До електродів першого роду відносять також газові електроди, оборотні відносно катіона чи аніона (кисневий, хлорний, водневий). Такі електроди складаються з інертного металу, що знаходиться одночасно в контакті з газом і розчином, що містить іони цього газу. Наприклад, водневий електрод складається з платинової пластинки, покритої шаром платинової чорноти для забезпечення достатньої площі поверхні і зануреної в розчин, що містить іони водню. Таку платиновану пластинку повинен постійно обтікати газоподібний водень. Водневий електрод називають стандартним, якщо активність іонів водню в розчині а Н+=1 і тиск газоподібного водню  рівний 101325 Па.
рівний 101325 Па.
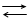 Водневому електроду Н+│Н2, Pt відповідає реакція Н+ + ‘ ½ Н2 і електродний потенціал
Водневому електроду Н+│Н2, Pt відповідає реакція Н+ + ‘ ½ Н2 і електродний потенціал
 (XIV.4.2)
(XIV.4.2)
Прийнявши, що активність газоподібного водню відповідає його тиску, одержимо
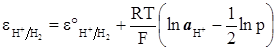 (XIV.4.3)
(XIV.4.3)
Потенціал стандартного водневого електроду  умовно прийнятий рівним нулю. Тоді за умови, що
умовно прийнятий рівним нулю. Тоді за умови, що  , потенціал водневого електрода визначатиметься так:
, потенціал водневого електрода визначатиметься так:
 (XIV.4.4)
(XIV.4.4)
Відносно потенціалу стандартного водневого електрода виміряні потенціали для більшої кількості електродних реакцій (Т = const), що дає можливість розв’язувати різні електрохімічні завдання. Якщо розмістити стандартні електродні потенціали для різних металів так, щоб їх величини зростали, то утвориться ряд напруг, відомий із загального курсу хімії (табл. 4). Вказана послідовність стандартних електродних потенціалів у значній мірі відповідає послідовності зміни їх властивостей і тому служить важливим орієнтиром при оцінці можливості протікання різних реакцій.
Деяка невідповідність між хімічними властивостями металів і величинами їх стандартних електродних потенціалів пов’язана з тим, що останні залежать не лише від активності металів, але і від міцності сольватної оболонки потенціал-визначаючих іонів. Так, іони літію внаслідок їх малих розмірів міцно зв’язані з полярними молекулами води, тому перехід іонів літію з розчину в метал утруднений. Саме тому стандартний електродний потенціал літію є більш негативним за потенціали більш активних металів натрію і магнію.
Таблиця 4
Стандартні електродні потенціали при 298К
| Електрод | Електродна реакція |  Величина стандартного потенціалу, В Величина стандартного потенціалу, В
|
| Li+/Li | Li+ +  → Li → Li
| -3,045 |
| K+/K | K+ +  → K → K
| -2,925 |
| Ba2+/Ba | Ba2+ +  → Ba → Ba
| -2,906 |
| Ca2+/Ca | Ca2+ + 2  → Ca → Ca
| -2,866 |
| Na+/Na | Na+ +  → Na → Na
| -2,714 |
| Mg2+/Mg | Mg2+ + 2  → Mg → Mg
| -2,363 |
| Al3+/Al | Al3+ + 3  → Al → Al
| -1,622 |
| Mn2+/Mn | Mn2+ + 2  → Mn → Mn
| -1,180 |
| Zn2+/Zn | Zn2+ + 2  → Zn → Zn
| -0,763 |
| Cr3+/Cr | Cr3+ + 3  → Cr → Cr
| -0,744 |
| Fe2+/Fe | Fe2+ + 2  → Fe → Fe
| -0,440 |
| Cd2+/Cd | Cd2+ + 2  → Cd → Cd
| -0,403 |
| Co2+/Co | Co2+ + 2  → Co → Co
| -0,277 |
| Ni2+/Ni | Ni2+ + 2  → Ni → Ni
| -0,250 |
| Sn2+/Sn | Sn2+ + 2  → Sn → Sn
| -0,136 |
| Pb2+/Pb | Pb2+ + 2  → Pb → Pb
| -0,126 |
| Fe3+/Fe | Fe3+ + 3  → Fe → Fe
| -0,036 |
| H+/H2, Pt | H+ +  → ½H2 → ½H2
| ±0,000 |
| Cu2+/Cu | Cu2+ + 2  → Cu → Cu
| +0,337 |
| O2 /OH¯, Pt | ½O2 +H2O + 2  → OH¯ → OH¯
| +0,401 |
| Hg22+/Hg | ½Hg22+ +  → Hg → Hg
| +0,798 |
| Ag+/Ag | Ag+ +  → Ag → Ag
| +0,799 |
| Pt2+/Pt | Pt2+ + 2  → Pt → Pt
| +1,200 |
| Au3+/Au | Au3+ + 3  → Au → Au
| +1,498 |
| F2 /F¯ | ½F2 +  → F¯ → F¯
|   +2,870 +2,870
|
Електроди другого роду складаються з металу, який покритий шаром важкорозчинної сполуки цього металу і зануреного в розчин солі, що утворює такий же аніон, як і важкорозчинна сполука металу. Прикладом є хлорсрібний електрод Cl¯│AgCl, Ag, що містить срібну пластинку з осадом аргентум хлориду в розчині калій хлориду. Основний хімічний процес
 Ag+ + ē‘ Ag
Ag+ + ē‘ Ag
супроводжується реакцією розчинення або осадження солі AgCl:
 AgCl Ag+ + Cl-
AgCl Ag+ + Cl-
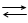 Сумарний процес AgCl + ē Ag + Cl- визначає вид рівняння для розрахунку потенціалу електрода, що оборотній відносно аніона:
Сумарний процес AgCl + ē Ag + Cl- визначає вид рівняння для розрахунку потенціалу електрода, що оборотній відносно аніона:
 . (XIV.4.5)
. (XIV.4.5)
Електрод другого роду можна розглядати як електрод першого роду, зворотний відносно катіона в якого активність іонів металу в розчині визначається розчинністю солі і його потенціал можна розрахувати за рівнянням:
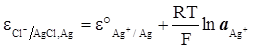 (XIV.4.6)
(XIV.4.6)
Іншим електродом другого роду є каломельний електрод Cl¯│Hg2Cl2, Hg, який складається з ртуті, що покрита каломеллю Hg2Cl2 і розміщена в розчині калій хлориду.
На цьому електроді протікають реакції:
 Hg+ + ē‘ Hg
Hg+ + ē‘ Hg
 ½ Hg2Cl2 Hg+ + Cl¯
½ Hg2Cl2 Hg+ + Cl¯
і сумарна реакція
 ½ Hg2Cl2 + ē‘ Hg + Cl¯
½ Hg2Cl2 + ē‘ Hg + Cl¯
Електродний потенціал обчислюють за рівняннями:
 (XIV.4.7)
(XIV.4.7)
 (XIV.4.8)
(XIV.4.8)
Є й інші електроди другого роду. Електроди другого роду відрізняються сталістю потенціалу і тому використовуються в ролі електродів порівняння.
Будь-які електроди є окислювально-відновними системами. Проте окислювально-відновними електродами (редокс – електродами) прийнято називати електроди, на яких відбуваються окиснювально-відновні реакції, що не супроводжуються фазовими переходами. Метал у редокс – електроді не бере участі в електродній реакції, а виконує лише функцію переносника електронів.
Розрізняють редокс – електроди, на яких відбувається реакція, що веде до зміни заряду іонів, наприклад:
 Sn4+ + 2ē Sn2+
Sn4+ + 2ē Sn2+
 MnO4¯ + ē MnO42-
MnO4¯ + ē MnO42-
Величини електродних потенціалів таких електролітів, які називають простими, визначається відношенням активності окисненої форми іонів до відновленої:
 (XIV.4.9)
(XIV.4.9)
 (XIV.4.10)
(XIV.4.10)
де  і
і  - стандартні окисно-відновні потенціали.
- стандартні окисно-відновні потенціали.
Якщо в реакціях окрім переходу електронів між окисником і відновником на електродах беруть участь іони водню, іони ОН¯ або молекули води, то такі редокс – електроди називають складними, наприклад:
 MnO4¯ + 8 H3O+ + 5ē Mn2+ + 12 H2O
MnO4¯ + 8 H3O+ + 5ē Mn2+ + 12 H2O
 SO42- + H2O + 2ē SO32- + 2 OH¯
SO42- + H2O + 2ē SO32- + 2 OH¯
Потенціали таких електродів визначатимуться за рівняннями:
 (XIV.4.11)
(XIV.4.11)
 (XIV.4.12)
(XIV.4.12)
Величина окиснювально-відновного потенціалу є мірою відновлювальної або окиснювальної здатності розчину. Чим сильніші відновлювальні властивості розчину, тим більш негативного потенціалу набуває електрод і навпаки.
В таблиці 5 наведені потенціали деяких окиснювально-відновних електродів для таких концентрацій реагуючих речовин, при яких активність рівна одиниці.
Якщо створити окиснювально-відновний ланцюг з двох електродів, які знаходяться вище і нижче в таблиці, наприклад:
(-) Pt│SnCl2,SnCl4││FeCl2,FeCl3│Pt (+)
то на лівому, з більш негативним потенціалом, протікатиме реакція окислення, а на правому, з більш позитивним потенціалом, - реакція відновлення.
Таблиця 5
Стандартні окиснювально-відновлювальні потенціали
у водному розчині при 298 К
| Електрод | Електродний процес | Е, В |
| Cr2+, Cr3+│Pt |  Cr3+ + 1ē‘ Cr2+ Cr3+ + 1ē‘ Cr2+
| -0,41 |
| Sn2+, Sn4+│Pt |  Sn4+ + 2ē‘ Sn2+ Sn4+ + 2ē‘ Sn2+
| +0,153 |
| Cu+, Cu2+│Pt |  Cu2+ + 1ē‘ Cu+ Cu2+ + 1ē‘ Cu+
| +0,167 |
| гідрохінон, хінон, Н+│Pt |  C6H4O2 + 2H+ 2ē C6H4(OH)2 C6H4O2 + 2H+ 2ē C6H4(OH)2
| +0,6994 |
| Fe2+, Fe3+│Pt |  Fe3+ + 1ē Fe2+ Fe3+ + 1ē Fe2+
| +0,783 |
| Mn2+, Mn3+│Pt |  Mn3+ + 1ē Mn2+ Mn3+ + 1ē Mn2+
| +1,51 |
| Pb2+, Pb4+│Pt |  Pb4+ + 2ē Pb2+ Pb4+ + 2ē Pb2+
| +1,70 |
| Co2+, Co3+│Pt |  Co3+ + 1ē Co2+ Co3+ + 1ē Co2+
| +1,82 |
Таким чином, верхній член ряду відновлює ті, що знаходяться нижче і є по відношенню до них відновлювачем, а ті, що нижче по відношенню до верхніх, навпаки, є окисниками.
Окиснювально – відновлюваний потенціал значно змінюється зі зміною співвідношення активностей окисненної (Ох) і відновленої (Red) форм. Чим вища активність (концентрація) окисненної форми, тим більш позитивне значення потенціалу даного електроду.
Окиснювально – відновлювальний потенціал для багатьох речовин залежить від рН розчинів. Цю залежність використовують для визначення рН розчинів. Часто з цією метою застосовують хінгідронний електрод.
 На практиці вимірювання рН розчинів широке розповсюдження набув скляний електрод. Цей електрод є скляною трубкою, на один кінець якої наплавлена скляна кулька зі спеціального скла з товщиною стінок 0, 01 – 0, 001 мм. Кулька заповнюється, зазвичай, 0,1 моль/л розчином соляної кислоти, в яку занурений хлор – срібний електрод (рис.79).
На практиці вимірювання рН розчинів широке розповсюдження набув скляний електрод. Цей електрод є скляною трубкою, на один кінець якої наплавлена скляна кулька зі спеціального скла з товщиною стінок 0, 01 – 0, 001 мм. Кулька заповнюється, зазвичай, 0,1 моль/л розчином соляної кислоти, в яку занурений хлор – срібний електрод (рис.79).
Скляний електрод занурюють у розчин, величину рН якого вимірюють, а електродом порівняння застосовують хлор – срібний (або каломельний) електрод. Сумарний потенціал скляного електрода ε складається з трьох стрибків потенціалу – стрибка потенціалу на межі досліджуваний розчин – скло εск1, скло – розчин соляної кислоти εск2 і потенціалу хлор – срібного електроду:
εсум= εск,1 + εск,2 + εCl¯/AgCl,Ag (XIV.4.13)
електрод в цілому можна представити у вигляді схеми:
 εск,1 εск,2 εCl¯/AgCl,Ag
εск,1 εск,2 εCl¯/AgCl,Ag
Досліджуваний скло НCl AgCl, Ag
розчин рН=? 0,1М
Електродна реакція в такій системі зводиться до обміну іонами водню між розчином і склом:
 Н+ (розчин) Н+ (скло)
Н+ (розчин) Н+ (скло)
Потенціал такого електрода визначається за рівнянням:
 (XIV.4.14)
(XIV.4.14)
В реакції обміну між іонами приймають участь також іони лужних металів (літію, натрію, калію), які входять до складу скла, наприклад:
 Н+ +
Н+ + 
 + Na+
+ Na+
Це дещо ускладнює розрахунок фактичного значення потенціалу скляного електрода. Потенціали внутрішнього хлор – срібного електроду і потенціал εск,2 – сталі величини. Єдина змінна величина - потенціал, що виникає на межі скло – досліджуваний розчин εсл,1, який визначається лише величиною його рН.
Кожний скляний електрод перед його використанням піддають спеціальному калібруванню за стандартним буферним розчином з точно визначеною величиною рН. Скляний електрод найбільш надійний з індикаторних електродів. Його можна застосовувати для вимірювань рН у широкому інтервалі його значень (0 – 12) у практично будь-яких розчинах, навіть в присутності сильних окисників і відновників.
Поиск по сайту: