 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
XIV.5. Концентраційні ланцюги
|
Читайте также: |
Концентраційним елементом називається елемент, в якому робота електричного струму одержується внаслідок самовільного вирівнювання концентрації між двома розчинами одного й того ж електроліту. Розрізняють два типи концентраційних елементів – з перенесенням і без перенесення іонів. Найпростіший концентраційний елемент з перенесенням іонів складається з двох однакових електродів, які занурюють у розчини з різною активністю потенціал визначаючих іонів, наприклад:
(-) Ag│AgNO3│AgNO3│Ag (+)
ε1 a 1 a 2 ε2
В такому елементі на обох електродах при замиканні ланцюга самовільно йдуть процеси в напрямку вирівнювання концентрацій у розчинах. Для електродних потенціалів відповідно одержимо:
 ,
, 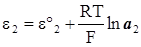 , (XIV.5.1)
, (XIV.5.1)
 .
.
Без урахування дифузійного потенціалу ЕРС концентраційного ланцюга рівна
 (XIV.5.2)
(XIV.5.2)
Для розбавлених розчинів замість активностей можна користуватись концентраціями:
 (XIV.5.3)
(XIV.5.3)
Концентраційні елементи без перенесення іонів складаються з двох електродів – твердих сплавів чи амальгам, але відрізняються за вмістом активної речовини. Обидва електроди занурені в один і той же розчин, що містить іони активної речовини. Суттєва відмінність таких елементів – відсутність межі між рідкими фазами і, значить, дифузійного потенціалу, який впливає на результат вимірювання ЕРС. Прикладом такого елемента може служити кадмієвий амальгамний елемент:
(-) Cda1, Hg│CdSO4│Cda2,Hg (+)
При роботі такого елемента відбувається перенесення кадмію від більш концентрованої амальгами до менш концентрованої. ЕРС такого елемента (при  1>
1>  2) рівна:
2) рівна:
 (XIV.5.4)
(XIV.5.4)
Ця формула справедлива лише при умові, що метали, які входять до складу амальгами (сплаву), не утворюють хімічних сполук. Вимірюючи ЕРС гальванічних елементів, слід звертати увагу на можливість виникнення стрибка потенціалу на межі дотику двох розчинів. Така різниця потенціалів називається дифузійним потенціалом. Він виникає в наслідок того, що при дифузії електроліту концентрованого розчину в більш розбавлений той іон, який є більш рухливим, випереджає менш рухливий іон. Якщо більш рухливими іонами будуть катіони, то біля межі розділу розчинів зі сторони більш розбавленого створюється позитивний заряд, а з сторони концентрованого – негативний. Дифузійний потенціал на межах різних розчинів змінюється від 1 – 2 до 30 – 35 мВ. Тому при точних вимірюваннях ЕРС слід враховувати дифузійний потенціал або застосовувати методи, що дозволяють якщо не усунути, то хоча б зменшити його до декількох мілівольт. Частіше всього для цього включають між обома розчинами проміжний концентрований розчин з іонами, що мають найбільш близькі рухливості, наприклад KCl i KNO3.
Теорія дифузійного потенціалу розроблялась М. Плакном, Гендерсоном і ін. Одержані ними формули розрахунку дифузійного потенціалу досить складні. Розв’язок значно спрощується, якщо дифузійний потенціал виникає на межі двох розчинів з різними концентраціями с1 і с2 одного і того ж електроліту. В цьому випадку дифузійний потенціал εД рівний:
 (XIV.5.5)
(XIV.5.5)
Для концентрованих розчинів відношення концентрацій 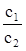 в (XIV.5.5) слід замінити відношенням активностей
в (XIV.5.5) слід замінити відношенням активностей  .
.
Проста формула отримується для розрахунку потенціалу на межі розчинів рівних концентрацій бінарних електролітів із загальним катіоном або аніоном (наприклад, NaCl i KСl або розчинів KCl i KNO3 рівних концентрацій). У першому випадку
 , (XIV.5.6)
, (XIV.5.6)
в другому випадку
 . (XIV.5.7)
. (XIV.5.7)
Різниця потенціалів виникає і на межі дотику рідин, що не змішуються, в яких розчинені електроліти. Позитивні і негативні іони, з яких складається електроліт, у цих розчинниках розподіляються неоднаково, їх коефіцієнти розподілення не співпадають. Тому на межі розділу рідин виникає стрибок потенціалу.
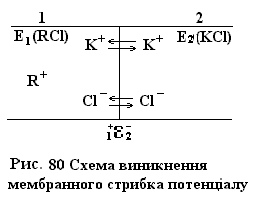 Якщо два розчини електролітів розділити напівпровідною перетинкою, то виникає так званий мембранний потенціал (потенціал Донана) (рис. 80.)
Якщо два розчини електролітів розділити напівпровідною перетинкою, то виникає так званий мембранний потенціал (потенціал Донана) (рис. 80.)
Помістимо зліва від мембрани електроліт RCl, катіони R+ якого не проходять через мембрану, а з права електроліт KCl. Приймемо для простоти, що активності іонів Сl- рівні по обидві сторони мембрани. Іони K+ i Cl- проходять через мембрану. Внаслідок дифузії частина катіонів K+ перейде в ліву частину системи і розчин зліва отримає надлишковий позитивний заряд, а справа – негативний. Встановлюється відповідна рівновага і виникає стрибок потенціалу  . Внаслідок обміну іонами по обидві сторони мембрани активності катіонів і аніонів змінюються таким чином, що їх добуток зліва і справа виявляється рівним:
. Внаслідок обміну іонами по обидві сторони мембрани активності катіонів і аніонів змінюються таким чином, що їх добуток зліва і справа виявляється рівним:
 (XIV.5.8)
(XIV.5.8)
де індексами А і К позначені катіони і аніони. Це є так зване рівняння Донана.
Знайдено, що потенціал Донана (εм) пов’язаний з рівноважними активностями катіонів і аніонів по обидві сторони мембрани рівнянням:
 (XIV.5.9)
(XIV.5.9)
при умові, що заряд катіона рівний заряду аніона (|zK|=zA).
Концентраційні елементи дозволяють розв’язувати ряд важливих проблем: визначати рН розчинів, добутки розчинності, валентності іонів важкорозчинних речовин, константи нестійкості комплексних іонів тощо, а дифузійні і міжрідинні потенціали відіграють велику біологічну роль. Їх наявність породжує так звані біотоки.
Поиск по сайту: