 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
IV. По направлению
По направлению различают:
1. Необратимые реакции протекают в данных условиях только в одном направлении.
К ним можно отнести все реакции обмена, сопровождающиеся образованием осадка, газа или малодиссоциирующего вещества (воды) и все реакции горения.
Обратимые реакции в данных условиях протекают одновременно в двух противоположных направлениях.
Таких реакций подавляющее большинство.
В органической химии признак обратимости отражают названия – антонимы процессов: гидрирование – дегидрирование, гидратация – дегидратация.
6. Тепловой эффект химической реакции
По тепловому эффекту реакции делят на экзотермические и эндотермические.
1.Экзотермические реакции протекают с выделением энергии.
К ним относятся почти все реакции соединения.
N2 + O2 = 2NO – Q
Экзотермические реакции, которые протекают с выделением света, относят к реакциям горения, например:
4P + 5O2 = 2P2O5 + Q
Гидрирование этилена – пример экзотермической реакции:
| CH2=CH2+H2 | 
| CH3–CH3 | + Q |
Она идет при комнатной температуре.
2.Эндотермические реакции протекают с поглощением энергии.
Очевидно, что к ним будут относиться почти все реакции разложения, например:
Обжиг известняка:
| CaCO3 | 
| CaO+CO2↑ | – Q |
Количество выделенной или поглощенной в результате реакции энергии называют тепловым эффектом реакции, а уравнение химической реакции с указанием этого эффекта называют термохимическим уравнением, например:
H2(г) + Cl2(г) = 2HCl(г) + 92,3 кДж
N2(г) + O2(г) = 2NO(г) – 90,4 кДж
7. Химическое равновесие
Пример. Реакция синтеза аммиака является обратимой:N2 + 3H2 2NH3
Прямая и обратная реакции протекают одновременно в противоположных направлениях. Во всех обратимых реакциях скорость прямой реакции уменьшается, скорость обратной реакции возрастает до тех пор, пока обе скорости не станут равными и не установится состояние равновесия.
В состоянии равновесия скорости прямой и обратной реакции становятся равными – условие хим. равновесия
Современная формулировка принципа Ле-Шателье такова:Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то система перейдет в другое состояние так, чтобы уменьшить эффект внешнего воздействия, т.е. равновесие смещается в сторону той реакции, которая ослабляет это воздействие.
1. Влияние температуры. В каждой обратимой реакции одно из направлений отвечает экзотермическому процессу, а другое - эндотермическому. N2 + 3H2 2NH3 + Q
Прямая реакция - экзотермическая, а обратная реакция - эндотермическая. Влияние изменения температуры на положение химического равновесия подчиняется следующим правилам: При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры - в направлении экзотермической реакции.
2. Влияние давления. Во всех реакциях с участием газообразных веществ, сопровождающихся изменением объема за счет изменения количества вещества при переходе от исходных веществ к продуктам, на положение равновесия влияет давление в системе.
Влияние давления на положение равновесия подчиняется следующим правилам: При повышении давления равновесие сдвигается в направлении образования веществ (исходных или продуктов) с меньшим объемом;
при понижении давления равновесие сдвигается в направлении образования веществ с большим объемом

3. Влияние концентрации. Влияние концентрации на состояние равновесия подчиняется следующим правилам: При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции; при повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
давление, МПа 0,1 10 20 30 60 100
объемная доля NH3, % 0,4 26 36 46 66 80
8. Окислительно-восстановительные реакции
Реакции, идущие с изменением степеней окисления элементов, или окислительно-восстановительные реакции. Степень окисления – это условный заряд атома в соединении, вычисленный из предположения, что соединение состоит только из ионов.

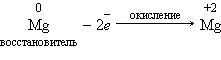


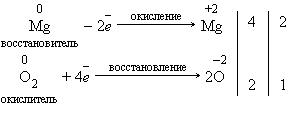
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается. Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается. Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
9. Растворы.
Раствором называется гомогенная (однородная) система, состоящая из двух или более независимых компонентов (растворенное вещество и растворитель), а также продуктов их взаимодействия. Компонент, количество которого преобладает в данной системе, называют растворителем.
По агрегатному состоянию растворы делятся:
- газообразные растворы: воздух – это раствор кислорода, паров воды, углекислого газа СО2 и благородных газов в азоте;
- твердые растворы: сплавы металлов;
- жидкие растворы в свою очередь делятся:
- растворы твердых веществ в жидкостях: соль+Н2О, сахар+Н2О, йод+Н2О
- растворы газообразныхых веществ в жидкостях: лимонады, нашатырный спирт
3. растворы жидких веществ в жидкостях: уксус, водка (спирт + вода)
По относительным количествам растворенного вещества и растворители растворы бывают: разбавленные и концентрированные.
По соотношению преобладания частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и перенасыщенные.
Насыщенный раствор - это раствор, который находится в равновесии с твердой фазой растворенного вещества и содержит максимально возможное при данных условиях количество этого вещества.
Раствор концентрация которого ниже концентрации насыщенного раствора называется ненасыщенным. В таком растворе можно при тех же условиях растворить дополнительное количество того же самого вещества.
П еренасыщенным называется раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем возможно в насыщенном растворе. Перенасыщенный раствор нестабилен, и при изменении условий (например при энергичном встряхивании или внесении кристаллика соли – затравки для кристаллизации) образуется насыщенный раствор и осадок кристаллов соли.
Количественной характеристикой соотношения компонентов насыщенного раствора является растворимость. Наиболее распространенными способами такой характеристики служат:
· коэффициент растворимости вещества (Р) – наибольшая масса вещества, способная при данной температуре раствориться в 100 г растворителя. Например, при 20ْ С в 100 г воды с образованием насыщенного раствора растворяется 36,0 г NaCI, значит Р(NaCI) = 36.
· молярная растворимость вещества (S) - число молей вещества, способное при данной температуре раствориться в 1 л указанного растворителя с образованием насыщенного раствора. Так, S(NaCI) = 6,154 моль\л
· коэффициент поглощения газа –наибольший объем газа, который может раствориться в единице объема растворителя при данной температуре и парциальном давлении газа 1 атм. Так при 20ْ С коэффициенты поглощения водой азота и кислорода, молекулы которых неполярны,составляют соответственно 0,016 и 0,031. Для газов, молекулы которых полярны, коэффициент их поглощения водой значительно выше, например для HCI – 500, NH3 – 1300.
Растворимость веществ существенно зависит от природы растворяемого вещества и растворителя, температуры и давления.
Зависимость от природы реагирующих веществ
Наибольшая растворимость достигается тогда, когда эти силы межмолекулярного взаимодействия имеют подобный характер: «подобное растворяется в подобном». Так вещества с ионным типом химической связи (соли, щелочи) или, полярные (спирты, альдегиды) хорошо растворимы в полярных растворителях, например в воде. И наоборот малополярные соединения, например оксид углерода (II) хорошо растворимы в неполярных соединениях, например в сероуглероде.
Зависимость от температуры.
Так как растворение процесс обратимый, значит к нему применим принцип Ле-Шателье: если растворение вещества происходит с поглощением теплоты, то повышение температуры приводит к увеличению растворимости.
Для большинства твердых веществ повышение температуры способствует увеличению растворимости.
Для газов повышение температуры способствует уменьшению растворимости, так как связи между молекулами растворимого вещества и растворителя - непрочные.
10. Теория электролитической диссоциации
10.1. Электролитами он назвал вещества, водные растворы которых проводят электрический ток, а неэлектролитами – вещества, водные растворы которых не проводят электрический ток.
Для объяснения свойств водных растворов электролитов шведский ученый С. Аррениус (1859–1927) в 1887 г. предложил теорию электролитической диссоциации. Согласно этой теории, при растворении в воде электролиты распадаются на свободные ионы. Этот процесс назвали электролитической диссоциацией. Растворы веществ тогда становятся проводниками электрического тока, когда они содержат ионы (положительно или отрицательно заряженные частицы), которые в электрическом поле приходят в направленное движение.
Электролитами могут быть только вещества с ионной и ковалентной полярной связями (соли, основания, кислоты).
Поиск по сайту: