 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
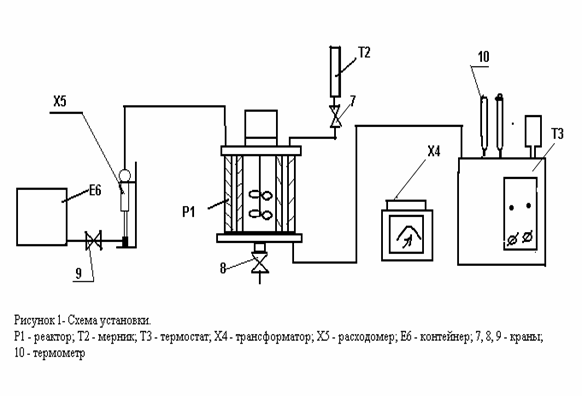
Порядок выполнения работы. Схема установки представлена на рисунке 1
Схема установки представлена на рисунке 1. Установка включает реактор Р1, мерник Т2, термостат Т3, лабораторный трансформатор Х4, расходомер Х5, контейнер Е6, соединительные линии, краны и зажимы.
Реактор Р1, в котором осуществляется абсорбция углекислого газа раствором, снабжен рубашкой для подогрева раствора и мешалкой. Мешалка имеет накрест расположенные на двух уровнях лопасти. Нижние лопасти служат для турбулизации жидкости, а верхние, которые только частично погружаются в раствор, служат для удаления с поверхности раздела фаз поверхностно-активных веществ, практически всегда присутствующих в неконтролируемых количествах и мешающих абсорбции газа.
Для обеспечения герметичности рабочего объема реактора, вал мешалки имеет сальниковые уплотнения. Термостат Т3 служит для поддержания данной температуры в циркуляционном контуре, включающем рубашку реактора, змеевик термостата.
Трансформатор Х4 (ЛАТР) предназначен для изменения напряжения питания электродвигателя-привода мешалки, а следовательно, для изменения числа оборотов мешалки.
Расходомер мыльно-пленочный Х5 предназначен для определения расхода углекислого газа, поступающего в реактор.
Контейнер полиэтиленовый Е6 предназначен для создания необходимого запаса углекислого газа.
Краны 7, 8 и зажим 9 - для слива раствора из мерника, реактора и регулирования подачи углекислого газа из контейнера, соответственно.
Термометром 10 замеряют температуру раствора в реакторе.
Порядок выполнения работы
1. Заполнить контейнер Е6 углекислым газом из баллона.
2. Залить в мерник Т2 определенное количество воды (первоначально измерив или до метки).
3. Задать температуру 20 - 25° С на электроконтактном термометре (ЭКТ) термостата, включить привод циркуляционного насоса термостата (ручка 3а).
4. Слить воду из мерника Т2 в реактор Р1. Кран 7 оставить открытым.
5. Открыть зажим 8 и пропустить некоторое количество, примерно 0,5 - 0,7 л углекислого газа через реактор. Ускорение пропуска газа достигается легким нажатием руки на контейнер.
6. Закрыть кран 7. С помощью мыльно-пленочного расходомера определить количество углекислого газа, поступающего на абсорбцию в реактор.
7. Включить привод мешалки и, регулируя трансформатором напряжение питания (около 100 В), установить минимальную скорость вращения мешалки. Определить скорость абсорбции углекислого газа.
8. Повторить опыт при других оборотах мешалки, меняя напряжение питания электродвигателя через 20 В до 220 В.
9. Повторить опыт при той же температуре и в том же порядке, но используя в качестве абсорбента карбонат-бикарбонатный раствор.
10. Задать на ЭКТ температуру на 10 - 15° С выше (35 - 40 °С) и повторить опыт. Для ускорения выхода на заданный температурный режим включить дополнительный нагрев (ручка 3б) термостата. При достижении температуры на 2-3° С меньше заданной дополнительный нагрев выключить.
11. Повторить опыт при более высокой (на 10 -15° С выше) температуре абсорбента (50 -55 °С).
Методы расчета
Физическая абсорбция
 Определение коэффициента молекулярной диффузии углекислого газа в воде
Определение коэффициента молекулярной диффузии углекислого газа в воде
Количество газа (моль), абсорбируемого единицей спокойной поверхности жидкости (см2) за какое-то время t равно:
 ,
,
где А* - концентрация газа растворенного у поверхности жидкости, равновесная с составом газа в основной массе жидкости, моль/см3;
А0 – концентрация растворенного газа в основной массе жидкости, моль/см3;
DА – коэффициент диффузии углекислого газа в воде, см2/с;
t - время абсорбции, с.
Поскольку объем воды в реакторе большой, то прирост концентрации углекислого газа в массе жидкости за короткий период абсорбции незначителен и им можно пренебречь, т.е. можно принять А0 = 0.
Равновесная концентрация углекислого газа может быть определена по данным, приведенным в таблице 3 приложения.
Определение коэффициента массоотдачи углекислого газа в воде
Скорость абсорбции углекислого газа, перемешиваемого непроточной водой может быть определена по формуле:
RА = KL*×a×(A* - A0),
где RА – скорость абсорбции за время t, моль/(см3×с);
а – поверхность контакта, отнесенная к единице объема жидкости, см –1;
KL* - коэффициент массоотдачи в жидкой фазе, см/с.
По указанной выше причине можно принять А0 = 0 и по данным опытов при разной интенсивности перемешивания определить коэффициент массоотдачи.
Абсорбция углекислого газа карбонат-бикарбонатным раствором
Определение константы скорости
псевдопервого порядка
 |
В случае массопереноса газа в растворе молекулярной диффузией (при отсутствии перемешивания), процесс сопровождается реакцией первого порядка и при условии k1 >>1 скорость абсорбции может быть рассчитана по уравнению
 .
.
Проводя опыты по абсорбции углекислого газа карбонат-бикарбонатным раствором при различных температурах можно определить константы скорости реакции при каждой из них и энергию активации реакции.
 Определение коэффициента ускорения абсорбции углекислого газа карбонат-бикарбонатным раствором
Определение коэффициента ускорения абсорбции углекислого газа карбонат-бикарбонатным раствором
Поглотительный раствор обладает буферными свойствами и в процессе абсорбции углекислого газа в течение какого-то времени химическая активность раствора остается постоянной. Это позволяет рассматривать процесс стационарным, у которого скорости стадий (абсорбции и химической реакции) равны
RА = KL/×a×(A* - A0) = k1×A0, где КL/ - коэффициент массоотдачи, осложненный химической реакцией, см/с.
За счет химической реакции коэффициент массоотдачи увеличивается в несколько раз по сравнению с физической абсорбцией:
КL/ = e × КL*
e - параметр называют коэффициентом ускорения массоотдачи.
В уравнение входит неизвестная концентрация углекислого газа в массе раствора А0. Для исключения неизвестной концентрации А0 запишем отдельно выражение скоростей массопереноса и реакции, преобразуем и сложим:
RА = KL/×a×(A* - A0)
RА = k1×A0

+

____________________________

Тогда RА = 
Или
 .
.
Первый член в знаменателе уравнения (1/k1) характеризует величину сопротивления протекания химической реакции, второй (1/КL/×а) – величину сопротивления массопереноса. Сопоставляя коэффициенты массоотдачи физической абсорбции и хемосорбции, полученные при одинаковых температуре и интенсивности перемешивания, можно по уравнению определить коэффициент ускорения.
 Результаты эксперимента
Результаты эксперимента
Абсорбция углекислого газа водой
VH2O = 112 мл, t = 24 ºC
| U | |||||||
| t,сек | 26,9 | 24,6 | 20,2 | 15,7 | 17,2 | 20,9 | |
| t,сек | 100,85 | 27,4 | 24,3 | 20,3 | 16,0 | 17,0 | 20,1 |
| t,сек | 100,63 | 27,6 | 24,1 | 20,7 | 15,9 | 17,4 | 20,4 |
| t | 100,82 | 27,3 | 24,33 | 20,4 | 15,86 | 17,2 | 20,5 |
Абсорбция углекислого газа карбонат-бикарбонатным раствором
V = 112 мл, t = 24 ºC
| U | |||||||
| t,сек | 28,1 | 20,4 | 18,2 | 17,0 | 15,4 | 15,7 | 15,7 |
| t,сек | 28,8 | 19,7 | 18,4 | 17,1 | 15,6 | 15,9 | 16,8 |
| t,сек | 29,2 | 20,1 | 18,7 | 17,4 | 15,9 | 16,2 | 16,9 |
| t | 28,7 | 20,1 | 18,4 | 17,2 | 15,6 | 15,9 | 16,5 |
V= 112 мл, t = 45 ºC
| U | |||||||
| t,сек | 17,3 | 17,4 | 16,3 | 16,0 | 15,0 | 14,5 | |
| t,сек | 33,2 | 17,7 | 17,7 | 16,6 | 16,1 | 15,4 | 14,6 |
| t,сек | 32,9 | 18,2 | 17,6 | 16,8 | 15,8 | 15,7 | 14,6 |
| t | 33,4 | 17,7 | 17,6 | 16,5 | 16,0 | 15,4 | 14,6 |
V = 112 мл, t = 53 ºC
| U | |||||||
| t,сек | 29,1 | 15,7 | 15,9 | 15,1 | 14,9 | 14,4 | |
| t,сек | 30,6 | 15,8 | 16,1 | 15,2 | 14,9 | 14,7 | 14,7 |
| t,сек | 29,7 | 15,4 | 15,9 | 15,5 | 14,9 | 14,2 | 13,9 |
| t | 29,8 | 15,63 | 15,97 | 15,27 | 14,90 | 14,43 | 14,53 |
 РАСЧЕТЫ
РАСЧЕТЫ
Определение коэффициента молекулярной диффузии углекислого газа в воде.
Количество газа (моль), абсорбируемого единицей спокойной поверхности жидкости (см2) за какое-то время t равно:
Q = (1/22.4)/(25.2*τ)
Абсорбция углекислого газа водой
Определяем DA из уравнения  ; А0 = 0. А* = 0,759
; А0 = 0. А* = 0,759
RA = (1/22.4)/(112*τ) KL*×a = RА /(A* - A0),
| U | |||||||
| V, см3 | |||||||
| t | 100,82 | 27,3 | 24,33 | 20,4 | 15,86 | 17,2 | 20,5 |
| RА*10-5 | 0,4 | 1,4 | 1,6 | 1,9 | 2,5 | 2,3 | 1,9 |
| Q | 0,000018 | 0,000073 | 0,000082 | 0,000097 | 0,000125 | 0,000115 | 0,000097 |
| DА*10-10 | 0,04 | 2,64 | 3,72 | 6,32 | 13,4 | 10,5 | 6,23 |
| KL*× a | 0,0000051 | 0,0000189 | 0,0000212 | 0,0000253 | 0,0000325 | 0,0000300 | 0,0000252 |
Абсорбция углекислого газа карбонат-бикарбонатным раствором
V = 112 мл, t = 24 ºC
Определяем k1 из уравнения 
 коэффициентом ускорения массоотдачи находим из КL/ = e × КL*
коэффициентом ускорения массоотдачи находим из КL/ = e × КL*
| U | |||||||
| V, см3 | |||||||
| t | 28,7 | 20,1 | 18,4 | 17,2 | 15,6 | 15,9 | 16,5 |
| RА*10-5 | 1,36 | 1,95 | 2,13 | 2,28 | 2,51 | 2,46 | 2,37 |
| e | 3,51 | 1,36 | 1,32 | 1,19 | 1,02 | 1,08 | 1,24 |
| k1 | 77,45 | 2,50 | 2,11 | 1,42 | 0,81 | 1,00 | 1,57 |
| KL/ ×a | 0,000018 | 0,000026 | 0,000028 | 0,000030 | 0,000033 | 0,000032 | 0,000031 |
V= 112 мл, t = 45 ºC
| U | |||||||
| V, см3 | |||||||
| t | 33,4 | 17,7 | 17,6 | 16,5 | 15,4 | 14,6 | |
| RА*10-5 | 1,17 | 2,21 | 2,23 | 2,37 | 2,45 | 2,54 | 2,68 |
| e | 3,82 | 1,95 | 1,75 | 1,56 | 1,25 | 1,41 | 1,78 |
| k1 | 91,51 | 5,16 | 3,69 | 2,48 | 1,24 | 1,70 | 3,21 |
| KL/ ×a | 0,000020 | 0,000037 | 0,000037 | 0,000040 | 0,000041 | 0,000042 | 0,000045 |
V = 112 мл, t = 53 ºC
| U | |||||||
| V, см3 | |||||||
| t | 29,8 | 15,63 | 15,97 | 15,27 | 14,9 | 14,2 | 13,9 |
| RА*10-5 | 1,31 | 2,51 | 2,45 | 2,56 | 2,63 | 2,76 | 2,82 |
| e | 5,89 | 3,04 | 2,65 | 2,33 | 1,85 | 2,11 | 2,57 |
| k1 | 217,69 | 12,52 | 8,49 | 5,48 | 2,70 | 3,79 | 6,71 |
| KL/ ×a | 0,000030 | 0,000057 | 0,000056 | 0,000059 | 0,000060 | 0,000063 | 0,000065 |
 |
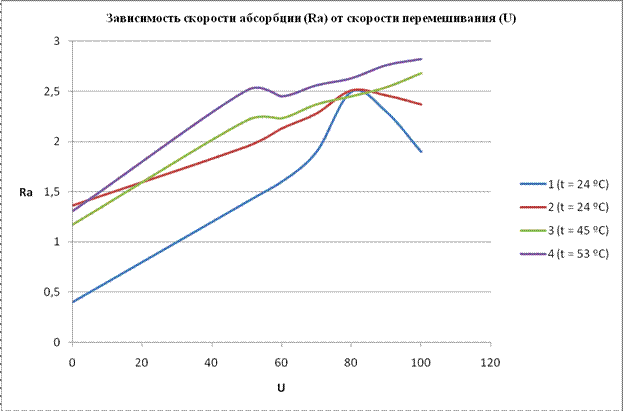
1- абсорбция СО2 водой, при t = 24 ºC
2- абсорбция СО2 карбонат-бикарбонатным раствором, при t = 24 ºC
3- абсорбция СО2 карбонат-бикарбонатным раствором, при t = 45 ºC
4- абсорбция СО2 карбонат-бикарбонатным раствором, при t = 53 ºC
 Вывод: при абсорбции СО2 водой, лимитирующая стадия лежит в диффузионной области, при абсорбции СО2 карбонат-бикарбонатным раствором, лимитирующая стадия лежит в переходной области, в которой процесс ускоряют как перемешиванием, так и повышением температуры.
Вывод: при абсорбции СО2 водой, лимитирующая стадия лежит в диффузионной области, при абсорбции СО2 карбонат-бикарбонатным раствором, лимитирующая стадия лежит в переходной области, в которой процесс ускоряют как перемешиванием, так и повышением температуры.
Поиск по сайту: