 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Химические свойства
Фенолы проявляют свойства слабых кислот.
(! поэтому гидроксогруппа не реагирует с кислотами)
1. +Ме
2. +основание
3.+карбонаты
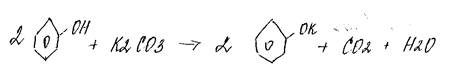
4.+FeCl3 (! качественная реакция (фиолетовый осадок))
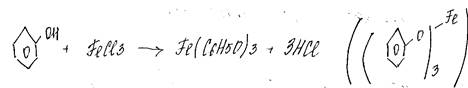
5.+кислота (HNO3, H2SO4)
гидроксогруппа направляет остатки NO2 и SO3H в орто и пара положения.
6.+бромная вода (! качественная реакция (белый осадок))
гидроксогруппа направляет Br в орто и пара положения.
7.Гидрирование
до циклоалкана
8.Окисление (до хинона)
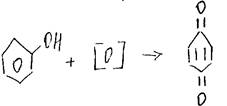
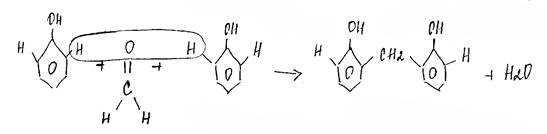
9.Поликонденсация (фенол с альдегидами)
Получение
1. Из каменноугольной смолы
смолу обрабатывают раствором щёлочи, образуются феноляты, затем с помощью кислоты выделяют фенол.
2. Сплавление аренсульфокислот со щёлочью

3. Взаимодействие галогенпроизводных ароматических УВ со щелочами (или с водяным паром).

4. Гидролиз солей диазония, получаемых из аминов.
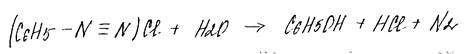
5. Взаимодействие фенолятов с углекислым газом и водой

Альдегиды и кетоны CnH2nO
Вещества, содержащие в своём составе карбонильную группу.
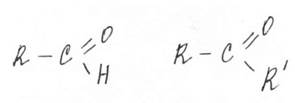
альдегид кетон
Номенклатура
НСОН – метан аль, муравьиный альдегид, формальдегид
СН3СОН – этан аль, уксусный альдегид, ацетальдегид
С2Н5СОН – пропан аль, пропионовый альдегид
С3Н7СОН – бутан аль, масляный альдегид
С4Н9СОН – пентан аль, валерьяновый альдегид
СН3-С(О)-СН3 – пентан он
Физические свойства
Полярные вещества с избыточной электронной плотностью на атоме кислорода.
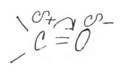
Низшие альдегиды и кетоны растворимы в воде.
t кипения ниже чем у спиртов
имеют резких запах (от 4 до 6 – неприятный; высшие применяются в парфюмерии)
Метаналь (формальдегид, муравьиный альдегид):
бесцветный газ
имеет резкий запах
ядовит
хорошо растворяется в воде, 40 % -ный раствор — формалин
Этаналь (ацетальдегид, уксусный альдегид):
жидкость без цвета
имеет резкий запах
хорошо растворяется в воде
tкип = 21°С
Изомерия
1.Структурная
а)углеродного скелета
б)межклассовая (альдегид=кетон)
в)положения карбонильной группы (! только для кетонов)
Поиск по сайту: