 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ХИМИЧЕСКАЯ КИНЕТИКА И КАТАЛИЗ
Химическая кинетика занимается исследованием механизмов реакций и течения их во времени.
Скорости биохимических реакций сбалансированы, за счет чего обеспечивается стационарное состояние организма. С одной стороны, изменение скорости какой-либо реакции, обусловленное воздействием факторов окружающей среды или особенностями развития организма, может быть причиной развития патологии. С другой стороны, при воздействии неблагоприятных факторов изменение скоростей реакций лежит в основе защитной и компенсаторной функций организма. Физиотерапевтические методы лечения основаны на изменении условий протекания реакций (локальное понижение/ повышение температуры), а фармакотерапевтические методы – на введении веществ, влияющих на скорость реакции.
Механизм реакции – последовательность и характер стадий химических реакций. По механизму различают простые и сложные реакции. Простые реакции осуществляются посредством однотипных элементарных актов. Для осуществления сложных реакций необходимы разнотипные (не менее двух) элементарные акты. Все биохимические реакции – сложные. Сложные реакции подразделяются на параллельные, последовательные, сопряженные и цепные.
Химические реакции многообразны и протекают с разной скоростью.
Скоростью химической реакции называют изменение концентрации какого-либо из реагирующих веществ в единицу времени в определённом объёме или на определённой поверхности. (Концентрация - содержание вещества в единице объёма).
Если реакция протекает идеально, то для оценки скорости достаточно пользоваться понятием средняя скорость. В этом случае рассматривают изменение концентрации вещества за некоторый промежуток времени и относят это изменение к единице времени
V = ±(c2-c1)/(τ2-τ1)=±Δc/Δτ.
Важно знать, по какому веществу оценивается скорость реакции. Если это исходное вещество, то концентрация его убывает V= - Δc/Δτ. Если контроль ведут по продукту реакции, то концентрация его возрастает V= + Δc/Δτ.
Однако в химической кинетике принят и другой способ оценки скорости химической реакции. Рассматривают характер графика c = f(τ) и скорость определяют по тангенсу угла наклона прямой к оси времени, т.е. Δс/Δτ = tg α (рис1). Если реакция протекает сложно, то для оценки протекания химического процесса пользуются понятием истинная скорость химической реакции. Её можно определить математически и графически.
Истинная скорость – это скорость реакции в данный момент времени. Причём в разные моменты она разная. Чем меньше рассматриваемый промежуток времени, тем точнее определяется скорость химической реакции. Размерность скорости, моль/л с. Математическое соотношение между скоростью и концентрацией называется кинетическим уравнением.
Математическое выражение скорости представляет собой производную концентрации во времени: Vист=± dc/dτ. В этом случае концентрация контролируемого вещества вполне определённа и её выражают в моль/л.

Рис. 1. Изменение во времени t концентрации Сн реагирующего вещества: а—к понятию о средней скорости реакции; б —к понятию об истинной скорости реакции
Скорость реакции зависит от многих факторов: концентрации, природы и дисперсности реагентов, температуры, катализатора, рН среды и др. Рассмотрим влияние этих параметров на скорость реакции.
Молекулы могут взаимодействовать лишь при столкновении. Чем чаще эти столкновения, тем быстрее пойдет реакция. Из этого следует, что для увеличения числа вероятных столкновений необходимо в данной системе увеличить количество молей реагирующих веществ, т. е. увеличить их концентрации. Чем больше столкновений произойдет между молекулами в единицу времени, тем больше будет скорость реакции, значит, количество столкновений зависит от числа молекул в единице объема, т. е. от молярной концентрации веществ.
Влияние концентрации на скорость химической реакции выражается закономдействующихмасс (К. Гульдберг и П. Вааге): при постоянной температуре скорость химической реакции прямо пропорциональна концентрации реагирующих веществ.
Так как скорость реакции А + В → D пропорциональна произведению концентраций веществ CА и CВ, то можно записать v = k CАCВ, где k — коэффициент пропорциональности, позволяющий учитывать различие между единицами измерения скорости и концентрации. В то же время коэффициент k, или константа скорости, указывает долю столкновений, которые приводят к осуществлению реакции. Если принять, что CА = CВ = 1 моль/л, тогда V=k. Поэтому константа скорости — это скорость реакции при концентрациях реагирующих веществ, равных единице. Если в реакцию вступает п молекул вещества А и т молекул вещества В nА + mB=gD, то коэффициенты п и т являются показателем степеней для концентраций соответствующих молекул и тогда закон действующих масс можно записать
v=k CА n CВ m.
Константа скорости k не зависит от концентраций веществ.
Закон действующих масс применим только к газообразным и растворенным веществам. Если наряду с ними в реакции участвуют и твердые вещества, концентрация которых постоянна, то скорость реакции изменяется только в зависимости от концентраций газов или растворенных веществ.
Молекулярность и порядок реакций. Число молекул, участвующих в элементарном акте химического взаимодействия, определяет молекулярность реакции. По этому признаку различают мономолекулярные, бимолекулярные и тримолекулярные реакции. Реакции с молекулярностью больше трех практически не встречаются, так как вероятность столкновения даже трех молекул уже очень мала.
Порядок реакции — это сумма показателей степеней концентрации веществ в уравнении закона действующих масс.
Так, реакция СuО(к) + Н2(г) = Сu(к) + Н2О (г)относится к реакциям первого порядка, так как уравнение закона действующих масс запишется следующим образом: v=kC(H2), а реакция H2+ I2 = 2HI относится к реакциям второго порядка, так как уравнение закона действующих масс имеет вид v =kC(H2)C(I2).
Молекулярность реакции - этомолекулярно-кинетическая характеристика системы, а порядок реакции определяет зависимость скорости от концентрации. Если при многостадийном процессе уравнение реакции отражает лишь исходное: и конечное состояние системы, не раскрывая механиз м процесса, то порядок реакции не совпадает сеемолекулярностью. Так, разложение N2O5 происходит согласно стехиометрическому уравнению 2N2O5=4NO2+O2, где для соблюдения баланса масс необходимо иметь две молекулы исходного соединения. Но экспериментально подтверждено, что данная реакция имеет первый порядок. На основании этого можно представить следующие стадии реакции:
N2O5=N2O3+O2
N2O3 + N2O5=4NO2
При этом скорость реакции в первой стадии значительно меньше, чем во второй.
Молекулярность реакции не совпадает с порядком и в тех случаях, когда разница между концентрациями реагирующих веществ весьма велика (например, гидролиз сахарозы в присутствии воды). Встречаются также реакции нулевого порядка (например, разложение аммиака на поверхности вольфрама), когда скорость не зависит от концентрации вещества в объеме, а также реакции дробного порядка (многостадийные процессы, где самые медленные стадии имеют разный порядок, однако их скорости соизмеримы). Поэтому нулевой или дробной молекулярности быть не может, так как эта характеристика относится к механизму реакции, а не к выражающему ее уравнению.
Необратимые реакции 1-го порядка (мономолекулярные)
К этим реакциям относятся реакции изомеризации, термического разложения веществ, радиоактивного распада атомных ядер.
Примеры:
СН3OСH3→ СН4 + H2 + СО; СН3N2СН3→ C2H6 + N2.
Дифференциальное уравнение скорости необратимой реакции I порядка, которая в общем виде может быть записана АВ, имеет вид:
 .
.
После интегрирования получается выражение для константы скорости реакции I порядка:
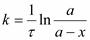 или
или
k = 2,3/ lg(Cн / Ск)
а – начальное количество моль вещества А, х – прореагировало моль за время.
k – константа скорости, 1/с,
Сн – начальная концентрация реагента моль/л,
Ск – конечная концентрация реагента в момент времени.
Время, в течение которого прореагировала половина начального количества вещества, т.е. х =  , называется временем полураспада и обозначается τ1/2.
, называется временем полураспада и обозначается τ1/2.
Для реакции первого порядка:
τ1/2 =  ,
,
следовательно, для необратимой реакции первого порядка время полураспада не зависит от начальной концентрации вещества.
Период превращения не зависит от начальной концентрации вещества. Величина 1/2 используется в радиоизотопных лабораториях для диагностики и лечения различных заболеваний, а также при исследовании действия лекарственных средств и их сохранности.
Подавляющее большинство реакций являются сложными. Это реакции, состоящие из ряда последовательных взаимосвязанных простых реакций. Скорость сложной реакции определяется скорость. Самой медленной простой реакции.
Зависимость скорости реакции от температуры. Энергия активации. Скорость химических реакций, как правило, при повышении температуры возрастает. Рассмотрим это на примере взаимодействия водорода с кислородом. При 20 °С скорость реакции практически равна 0 и понадобилось бы 54 млрд. лет, чтобы взаимодействие прошло на 15 %. При 500 °С для образования воды потребуется 50 мин, а при 700 °С реакция протекает мгновенно.
Зависимость скорости рекции от температуры выражается в приближенной форме правилом Вант-Гоффа, согласно которому при повышении температуры на каждые 10°С скорость реакции увеличивается примерно в 2 — 4 раза. Число, показывающее, во сколько раз увеличивается скорость данной реакции при повышении температуры на 10°, называется температурным коэффициентом реакции γ, т. е. выражается отношением константы скорости при температуре t + 100 к константе при температуре t:
γ (Δt/10)=kt+10/kt
Если кинетическая энергия сталкивающихся молекул достаточна для разрыва связей, то столкновение молекул приводит к перестройке молекул исходных веществ и образованию новых молекул. Избыточная энергия, которой должны обладать молекулы для того, чтобы их столкновение могло привести к образованию нового вещества, называется энергией активации. Молекулы, обладающие такой энергией, называются активными молекулами. С ростом температуры число таких молекул возрастает, поэтому скорость реакции тоже должна увеличиваться. Правило вант-Гоффа не применимо для реакций в живом организме. Для этого используют уравнение Аррениуса.
ln k = - (Ea/RT) + C (или k = Aexp(-Ea/RT).
В этом уравнении константа скорости k связана с экспоненциальным выражением exp(-Ea/RT).
Символ еxp означает основание натуральных логарифмов;
R- универсальная газовая постоянная;
Т — температура по шкале Кельвина;
Еа — энергия активации, которая обычно предполагается постоянной величиной, не зависящей от температуры;
А — коэффициент пропорциональности, иначе называется частотным множителем. Он указывает долю числа столкновений между молекулами, которая оканчивается реакцией.
Из уравнения Аррениуса следует, что правило Вант-Гоффа может выполняться для тех реакций, энергия активации которых лежит в пределах 84—170 кДж/моль. Современные исследования показали, что этот интервал значительно больше и находится в пределах 40 – 400 кДж/моль.
Чтобы понять, как применяется понятие энергии активациик конкретным химическим реакциям, рассмотрим реакцию взаимодействия водорода с йодом. В реакцию могут вступать только те молекулы, которые обладают повышенной энергией, позволяющей преодолеть активационный барьер. В реакции Н2 с I2 должны разорваться связи в Н •• Н и I •• I для образования HI. В определенный момент времени при сближении активных молекул, обладающих достаточной энергией для преодолениявзаимного отталкивания электронных облаков, возникает переходное состояние системы, отвечающее образованию промежуточного соединения, называемого активированным комплексом. Переходное состояние характеризуется тем, что промежуточный продукт имеет сходство как с начальными продуктами реакции, так и с конечными; связи между атомами в молекуле водорода еще не разорвались, а уже начала формироваться связь Н—I:

Координата реакции
Рис.2. Диаграмма потенциальной энергии (кДж/моль)
Разность энергий начального и конечного состояний системы равна тепловому эффекту реакции ΔН: ΔН = Е'А-Е"А.
Энергия активированного комплекса обычно выше энергии начального и конечного состояний системы. Можно сказать, что энергия активации — это своеобразный энергетический барьер, который отделяет исходные вещества от продуктов реакции. Из рис. 2 видно, что затраченная на активацию молекул энергия выделяется полностью или частично при образовании продуктов реакции. Если при этом энергии выделится больше, чем это необходимо для активации молекул, то реакция экзотермическая, если меньше - то эндотермическая.
Поиск по сайту: