 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
ЛЕКЦИЯ 12. ОСНОВНЫЕ ПОНЯТИЯ ХИМИЧЕСКОЙ КИНЕТИКИ
Термодинамика
· устанавливает принципиальную возможность химического процесса (∆ r GТ < 0)
· но! не отвечает на вопрос: как быстро идет процесс?
С6Н6(ж) → 6 С(тв) + 3 Н2 (г), ∆ r G 0298 = - 124,0 кДж
на практике бензол – инертен Þ
кинетические затруднения!
Кинетика изучает механизмы химических процессов, т.е. промежуточные стадии, через которые система переходит из начального в конечное состояние, скорости этих стадий и факторы, влияющие на их скорость.
Скорость реакции (υ) - количество вещества, образующееся в единице реакционного объёма (для гомогенной реакции) или на единице поверхности раздела фаз (для гетерогенной реакции) в единицу времени
Различают:
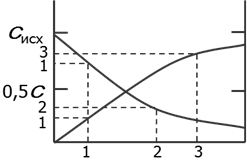
среднюю и истинную (мгновенную)скорости реакции
υ ср гомогенной реакции в промежуток времени τ 1÷ τ 2:
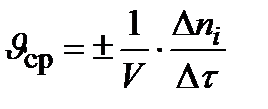 , при V = сonst:
, при V = сonst: 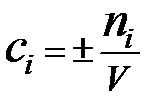 Þ
Þ 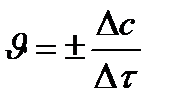
[ υ ] = [моль • л-1• с-1] – всегда положительна величина
Концентрация веществ меняется непрерывно:
исходных – убывает (- ∆ c),
продуктов – возрастает (+∆ c)
Þ
истинная скорость есть производная функции по τ:
для гомогенной для гетерогенной
реакции

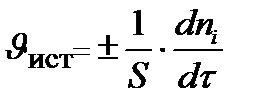
V – объём реакционной зоны;
S – поверхность раздела фаз; t – время;
n i – количество i -го исходного вещества
Для гомогенной реакции:
a A (р) + b B (р) → e E (р) + f F (р)
в некоторый момент времени:
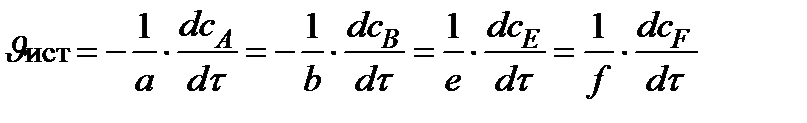
Элементарная реакция (одностадийная):единичный акт образования или разрыва связи, уравнение реакции отражает ее механизм
Сложная реакция (большинство реакций): состоит из нескольких элементарных стадий, уравнение реакции – суммарный результат нескольких элементарных процессов, совокупность элементарных стадий – механизм реакции
Элементарные реакции
В зависимости от числа исходных частиц, различают
1 – мономолекулярные: I2 ® 2I
2 – бимолекулярные: H2 + I2 ® 2HI
3 – тримолекулярные: 2NO + Cl2 ® 2NOCl
Молекулярность бывает: 1, 2, редко 3,
Молекулярность:
число частиц, участвующих в элементарной реакции
имеет физический смысл: М = 1, 2, 3
понятие применимо только к элементарным реакциям
Сложные реакции
протекают по стадиям:
CHCl3 + Cl2 → HCl + CCl4
Cl2 → 2Cl
Cl + CHCl3 → CCl3 + HCl
Cl + CCl3 → CCl4
понятие молекулярности для сложных реакций не имеет смысла
Cкорость реакции, протекающей в газовой фазе или растворе, зависит от:
природы реагирующих веществ,
их концентраций или парциальных давлений
температуры
наличия катализатора
Поиск по сайту: