 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Уравнение адсорбции Гиббса
Исходя из второго закона термодинамики американский ученый Гиббс в 70-х г. XIX в. вывел важное уравнение, связывающее величину адсорбции со способностью растворенного вещества изменять поверхностное натяжение раствора. Характеризует избыточную адсорбцию в зависимости от концентрации, температуры, изменении поверхностного натяжения.
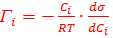 - развернутая форма адсорбционного уравнения.
- развернутая форма адсорбционного уравнения.
Где
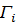 - избыточная адсорбция i-го компонента,
- избыточная адсорбция i-го компонента,
 – молярная концентрация в растворе,
– молярная концентрация в растворе,
 - температура, при которой происходит адсорбция,
- температура, при которой происходит адсорбция,
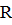 - универсальная газовая постоянная,
- универсальная газовая постоянная,
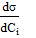 - изменение поверхностного натяжения раствора при изменении концентрации на
- изменение поверхностного натяжения раствора при изменении концентрации на 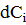 .
.
В такой форме уравнение Гиббса применяется для разбавленных растворов.
Для концентрированных растворов концентрацию (С) заменяют на активность (а): 
Он вывел его теоретически, в дальнейшем оно было подтверждено экспериментально Мак - Беном, Сазаки.
Проанализируем уравнение Гиббса.
Из уравнения видно, что влияние природы на адсорбцию заключено, в величине и знаке  :
:
если  то
то  , т.е. наблюдается положительная адсорбция, т.е. i-тое вещество концентрируется на поверхности раствора,
, т.е. наблюдается положительная адсорбция, т.е. i-тое вещество концентрируется на поверхности раствора,
если 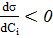 , то
, то 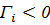 , т.е. наблюдается отрицательная адсорбция – вещество уходит с поверхности в раствор.
, т.е. наблюдается отрицательная адсорбция – вещество уходит с поверхности в раствор.
Для того чтобы рассчитать 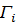 по уравнению адсорбции Гиббса, надо знать
по уравнению адсорбции Гиббса, надо знать  , т.е. производную поверхностного натяжения от концентрации i-го компонента.
, т.е. производную поверхностного натяжения от концентрации i-го компонента.
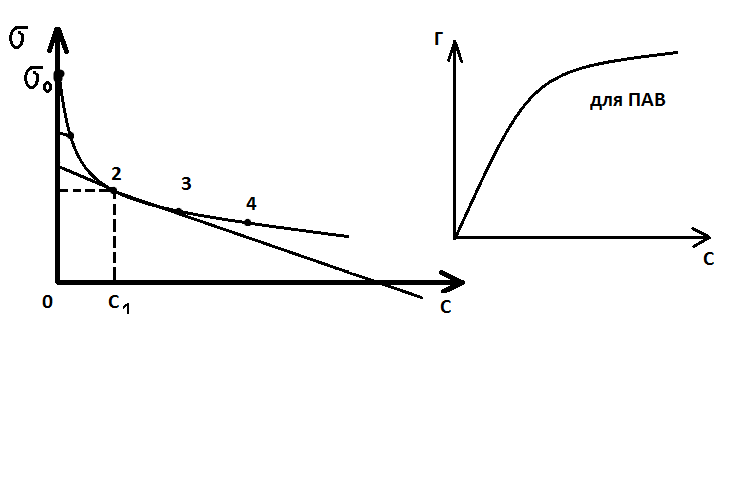
Следовательно имея зависимость 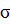 от С можно получить изотерму адсорбции данного компонента. Для этого нужно определить значение
от С можно получить изотерму адсорбции данного компонента. Для этого нужно определить значение  (при концентрации
(при концентрации 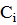 касательная в точке 1) в различных точках и подставить значения производных
касательная в точке 1) в различных точках и подставить значения производных  в уравнении адсорбции.
в уравнении адсорбции.
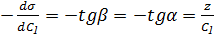 , отсюда
, отсюда
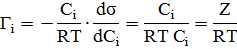
Так можно рассчитать значение адсорбции для любой концентрации и заполнить таблицу:

| 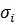
| 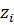
| 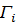
|

| 
| 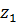
| 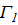
|
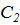
| 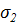
| 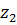
| 
|
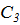
| 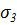
| 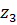
| 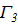
|

| 
| 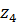
| 
|
Эти данные позволяют построить изотерму адсорбции 
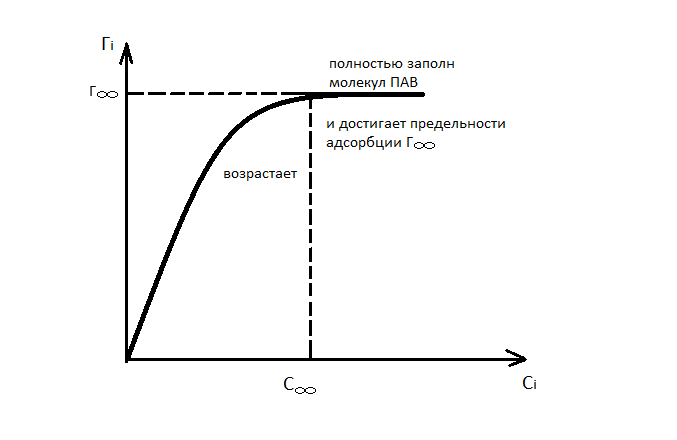
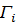 – избыточная или Гиббсовская адсорбция представляет избыток вещества в поверхностном слое, на единицу поверхности по сравнению с его концентрацией в объеме фазы.
– избыточная или Гиббсовская адсорбция представляет избыток вещества в поверхностном слое, на единицу поверхности по сравнению с его концентрацией в объеме фазы.
Поиск по сайту: