 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Тепловой машиной называется периодический действующий двигатель, совершающий работу за счет получаемого извне тепла
Любая тепловая машина работает по принципу кругового (циклического) процесса, т.е. возвращается в исходное состояние (рис. 5.1). Но чтобы при этом была совершена полезная работа, возврат должен быть произведен с наименьшими затратами.
Полезная работа равна разности работ расширения и сжатия, т.е. равна площади, ограниченной замкнутой кривой.
Обязательными частями тепловой машины являются нагреватель (источник энергии), холодильник, рабочее тело (газ, пар).
Зачем холодильник? Так как в тепловой машине реализуется круговой процесс, то вернуться в исходное состояние можно с меньшими затратами, если отдать часть тепла. Или если охладить пар, то его легче сжать, следовательно работа сжатия будет меньше работы расширения. Поэтому в тепловых машинах используется холодильник.
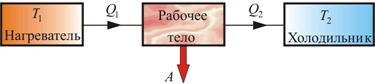
Рис. 5.3
рямой цикл используется в тепловом двигателе – периодически действующей тепловой машине, совершающей работу за счет полученной извне теплоты. Рассмотрим схему теплового двигателя (рис. 5.3). От термостата с более высокой температурой Т1, называемого нагревателем, за цикл отнимается количество теплоты Q1, а термостату с более низкой температурой Т2, называемому холодильником, за цикл передается количество теплоты Q2 и совершается работа A:  (5.2.1)
(5.2.1)
Обратный цикл используется в холодильных машинах – периодически действующих установках, в которых за счет работы внешних сил теплота переносится к телу с более высокой температурой. Принцип действия холодильной машины представлен на рисунке 5.4. Системой за цикл поглощается при низкой температуре T2 количество теплоты Q2 и отдается при более высокой температуре Т1 количество теплоты Q1 за счет работы внешних сил А.
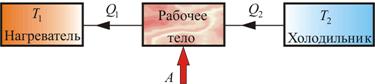
Рис. 5.4
Коэффицие́нт поле́зного де́йствия (КПД) — характеристика эффективности системы (устройства, машины) в отношении преобразования или передачи энергии. Определяется отношением полезно использованной энергии к суммарному количеству энергии, полученному системой; обозначается обычно η («эта»). КПД является безразмерной величиной и часто измеряется в процентах.
Математически определение КПД может быть записано в виде: 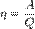 x 100 %,
x 100 %,
где А — полезная работа, а Q — затраченная энергия.
КПД теплово́го дви́гателя — отношение совершённой полезной работы двигателя, к энергии, полученной от нагревателя. КПД теплового двигателя может быть вычислен по следующей формуле  , где
, где  — количество теплоты, полученное от нагревателя,
— количество теплоты, полученное от нагревателя,  — количество теплоты, отданное холодильнику. Наибольшим КПД среди циклических машин, оперирующих при заданных температурах горячего источника T 1 и холодного T 2, обладают тепловые двигатели, работающие по циклу Карно; этот предельный КПД равен
— количество теплоты, отданное холодильнику. Наибольшим КПД среди циклических машин, оперирующих при заданных температурах горячего источника T 1 и холодного T 2, обладают тепловые двигатели, работающие по циклу Карно; этот предельный КПД равен  .
.
20. Энтропия. Статистическое столкновение энтропии.
Энтропия – сокращение достигнутой энергии вещества в результате передачи энергии.
КПД может быть равен 100% при преодразовании энергии в работу ΔS= ΔQ/T
ΔS – изменение энтропии ΔQ – изменение теплоты Т – абсолютная температура.
Если системе сообщают определённое количество теплоты, то энтропия системы возрастает.
Энтропия замкнутой системы не может самопроизвольно убывать. В изолированных системах самопроизвольно могут протекать только процессы сопровождающие увеличением энтропии.
Из II начала термодинамики вытекает III начало термодинамики, т.к. оно рассматривает поведение энтропии при приближении температуры к абсолютному 0.
Энтропия замкнутой системы – максимальна, при достижении системой равновесного состояния.
Из третьего начала термодинамики следует, что абсолютного нуля температуры нельзя достигнуть ни в каком конечном процессе, связанном с изменением энтропии, к нему можно лишь асимптотически приближаться, поэтому третье начало термодинамики иногда формулируют как принцип недостижимости абсолютного нуля температуры.
21. Второе и Третье начало термодинамики.
В наиболее очевидной формулировке второе начало гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
В. н. т. в формулировке Клаузиуса утверждает, что процесс, при к-ром не происходит никаких изменений, кроме передачи тепла от горячего тела к холодному, необратим, т. е. теплота не может самопроизвольно переходить от более холодного тела к более горячему (принцип Клаузиуса). Согласно формулировке Томсона, процесс, при к-ром работа переходит в тепло без к--л. иных изменений состояния системы, необратим, т. е. невозможно полностью преобразовать в работу всё тепло, взятое от тела, не производя никаких др. изменений состояния системы (принцип Tомсона). Принцип Томсона эквивалентен утверждению о невозможности вечного двигателя 2-го рода. Третье начало термодинамики (теорема Нернста) — физический принцип, определяющий поведение энтропии при абсолютном нуле температуры. Является одним из постулатов термодинамики. Третье начало термодинамики может быть сформулировано так: «Приращение энтропии при абсолютном нуле температуры стремится к конечному пределу, не зависящему от того, в каком равновесном состоянии находится система».  или
или 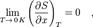
где  — любой термодинамический параметр.
— любой термодинамический параметр.
Заметим, что третье начало термодинамики относится только к равновесным состояниям.
Поскольку на основе второго начала термодинамики энтропию можно определить только с точностью до произвольной аддитивной постоянной (то есть, определяется не сама энтропия, а только её изменение): 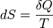 ,
,
22. Уравнение состояния реального газа. Силы взаимодействия между молекулами реального газа.
Реальные газы – газы, свойства которых зависит от взаимодействий молекул.
Наиболее простым и качественно верно отображающим поведение реального газа, является уравнение Ван-дер-Ваальса: (P + a/n2)·(n – b) = R·T. (6.3)
а, b – постоянные величины, первая учитывает силы взаимодействия, вторая учитывает размер молекул.
a/n2 – характеризует добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами и называется внутренним давлением. Для жидких тел это давление имеет большие значения, а для газов из-за малых сил сцепления молекул оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на её объем, и жидкость считают несжимаемой. В газах в виду малости значения a/n2 внешнее давление легко изменяет их объем.
Объясняя свойства реальных газов и жидкостей предположим, что на малых расстояниях действуют сила отталкивания, которая с увеличением расстояния сменяется силами притяжения. Молекулярное взаимодействие имеет электрический характер. Силы отталкивания возникают, когда происходит электрическое взаимодействие оболочек.
23. Внутренняя энергия реального газа. Конденсация и образование групп молекул. Эффект Джоуля-Томсана.
Внутренняя энергия реального газа будем определяться суммой кинетической энергии Eк теплового движения его молекул и потенциальной энергии взаимодействия молекул между собой - Eп: U=Eк+Eп.
Потенциальная энергия реального газа обусловлена только силами притяжения между молекулами. Наличие последних приводит к возникновению внутреннего давления p' на газ.
Работа, затрачиваемая на преодоления сил притяжения, равна приращению энергии. Следовательно, можно записать: δA=dEп=p'dV=(a/Vm2)dVm
Проинтегрировав это уравнение, получим: Eп=-a/Vm
Знак минус означает, что молекулярные силы, создающие дополнительное давление, являются силами притяжения. Окончательно внутренняя энергия моля реального газа: Um=CvT-(a/Vm) (73)
Из формулы для внутренней энергии реального газа следует, что его внутренняя энергия растет как с увеличением температуры, так и с увеличением объема. Если реальный газ будет расширяться или сжиматься адиабатически и без совершения внешней работы, то для него, согласно первому началу термодинамики: ΔQ=ΔU+ΔA; ΔQ=0, ΔA=0; ⇒ ΔU=0 → U=const,
и внутренняя энергия должна оставаться постоянной.
Поэтому, из формулы (73) для реального газа, совершающего адиабатический переход без совершения работы, можно записать: T1-T2=(a/Cv)[(1/Vm1)-(1/Vm2)] (74)
Из этого уравнения следует, что изменение объема и изменение температуры имеют разные знаки. Следовательно, при адиабатическом расширении в вакуум, реальный газ должен охлаждаться, а при сжатии - нагреваться.
Отметим, что для идеального газа этот эффект не наблюдается: ΔU=CvΔT=0 → ΔT=0 → T=const
Поиск по сайту: