 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Электрический ток в электролитах
Электролитами принято называть проводящие среды, в которых протекание электрического тока сопровождается переносом вещества. Носителями свободных зарядов в электролитах являются положительно и отрицательно заряженные ионы. К электролитам относятся многие соединения металлов с металлоидами в расплавленном состоянии, а также некоторые твердые вещества. Однако основными представителями электролитов, широко используемыми в технике, являются водные растворы неорганических кислот, солей и оснований.
Прохождение электрического тока через электролит сопровождается выделением веществ на электродах. Это явление получило название электролиза.
Электрический ток в электролитах представляет собой перемещение ионов обоих знаков в противоположных направлениях. Положительные ионы движутся к отрицательному электроду (катоду), отрицательные ионы – к положительному электроду (аноду). Ионы обоих знаков появляются в водных растворах солей, кислот и щелочей в результате расщепления части нейтральных молекул. Это явление называется электролитической диссоциацией. Например, хлорид меди CuCl2 диссоциирует в водном растворе на ионы меди и хлора:
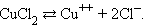
Во многих случаях электролиз сопровождается вторичными реакциями продуктов разложения, выделяющихся на электродах. Примером может служить электролиз водного раствора сульфата меди CuSO4 (медный купорос) в том случае, когда электроды, опущенные в электролит, изготовлены из меди.
Диссоциация молекул сульфата меди происходит по схеме

Нейтральные атомы меди отлагаются в виде твердого осадка на катоде. Таким путем можно получить химически чистую медь. Ион  отдает аноду два электрона и становится нейтральным радикал SO4 вступает во вторичную реакцию с медным анодом:
отдает аноду два электрона и становится нейтральным радикал SO4 вступает во вторичную реакцию с медным анодом:
SO4 + Cu = CuSO4
Образовавшаяся молекула сульфата меди переходит в раствор.
Таким образом, при прохождении электрического тока через водный раствор сульфата меди происходит растворение медного анода и отложение меди на катоде. Концентрация раствора сульфата меди при этом не  изменяется.
изменяется.
Закон электролиза был экспериментально установлен английским физиком М. Фарадеем в 1833 году. Закон Фарадея определяет количества первичных продуктов, выделяющихся на электродах при электролизе:
Масса m вещества, выделившегося на электроде, прямо пропорциональна заряду Q, прошедшему через электролит:
m = kQ = kIt.
Величину k называют электрохимическим эквивалентом.
Масса выделившегося на электроде вещества равна массе всех ионов, пришедших к электроду:

Здесь m0 и q0 – масса и заряд одного иона, N– число ионов, пришедших к электроду при прохождении через электролит заряда Q. Таким образом, электрохимический эквивалент k равен отношению массы m0 иона данного вещества к его заряду q0.
Так как заряд иона равен произведению валентности вещества n на элементарный заряд e (q0 = ne), то выражение для электрохимического эквивалента k можно записать в виде

Здесь NA – постоянная Авогадро, M = m0NA – молярная масса вещества,
F = eNA – постоянная Фарадея.
F = eNA = 96485 Кл / моль.
Постоянная Фарадея численно равна заряду, который необходимо пропустить через электролит для выделения на электроде одного моля одновалентного вещества.
Закон Фарадея для электролиза приобретает вид:

Явление электролиза широко применяется в современном промышленном производстве.
§21. ЭЛЕКТРИЧЕСКИЙ ТОК В ГАЗАХ
В естественном состоянии газ – диэлектрик. В обычных условиях в газе почти нет свободных носителей заряда, движение которых могло бы создать электрический ток.

Для того чтобы газ стал поводящим, необходимо создать в нем свободные заряженные частицы, т. е. превратить нейтральные молекулы (или атомы) в ионы.

Газ-проводник - это ионизированный газ.
 Ионизация газа. - это распад нейтральных атомов или молекул на положительные ионы и электроны путем отрыва электронов от атомов. Ионизация происходит при нагревании газа или воздействия излучений (УФ, рентген, радиоактивное) и объясняется распадом атомов и молекул при столкновениях на высоких скоростях.
Ионизация газа. - это распад нейтральных атомов или молекул на положительные ионы и электроны путем отрыва электронов от атомов. Ионизация происходит при нагревании газа или воздействия излучений (УФ, рентген, радиоактивное) и объясняется распадом атомов и молекул при столкновениях на высоких скоростях.
Процесс ионизации газа всегда сопровождается противоположным ему процессом восстановления нейтральных молекул из разноименно заряженных ионов вследствие их электрического (кулоновского) притяжения. Такой процесс называют рекомбинацией заряженных частиц.
 газ перестает быть проводником, если ионизация прекращается, это происходит вследствие рекомбинации (воссоединения противоположно заряженных частиц).
газ перестает быть проводником, если ионизация прекращается, это происходит вследствие рекомбинации (воссоединения противоположно заряженных частиц).
Газовый разряд - это электрический ток в ионизированных газах. Носителями зарядов являются положительные ионы и электроны. Газовый разряд наблюдается в газоразрядных трубках (лампах) при воздействии электрического или магнитного поля.
Существует самостоятельный и несамостоятельный газовый разряд.
Разряд, существующий только под действием внешних ионизаторов, называется несамостоятельным газовым разрядом.
Зависимость ток в газе от приложенного напряжения называется вольт-амперной характеристикой.
 На участке ОА выполняется закон Ома. Затем (участок АВ) рост силы тока замедляется, а затем (участок ВС) прекращается совсем. В этом случае число ионов и электронов, создаваемых внешним ионизатором равно числу ионов и электронов достигающих электродов (и нейтрализующихся на электродах). Ток Iнас, соответствующий участку ВС называется током насыщения и его величина определяется мощностью ионизатора.
На участке ОА выполняется закон Ома. Затем (участок АВ) рост силы тока замедляется, а затем (участок ВС) прекращается совсем. В этом случае число ионов и электронов, создаваемых внешним ионизатором равно числу ионов и электронов достигающих электродов (и нейтрализующихся на электродах). Ток Iнас, соответствующий участку ВС называется током насыщения и его величина определяется мощностью ионизатора.
При увеличении напряжения, первичные электроны, ускоренные электрическим полем, начинают ударно ионизовать молекулы газа, образуя вторичные электроны и ионы. Общее количество электронов и ионов будет возрастать по мере приближения электронов к аноду лавинообразно. Это является причиной увеличения тока на участке CD. Описанный процесс называется ударной ионизацией.
при значительных напряжениях положительные ионы, также приобретают энергию, достаточную для ионизации молекул газа, что порождает ионные лавины. Сила тока растет уже практически без увеличения напряжения (участок DE).
Лавинообразное размножение электронов и ионов приводит к тому, что разряд становится самостоятельным, т.е. сохраняется после прекращения действия внешнего ионизатора. Напряжение, при котором возникает самостоятельный газовый разряд называется напряжением пробоя.
Электрический пробой газа - процесс перехода несамостоятельного газового разряда в самостоятельный.
Самостоятельный газовый разряд бывает 4-х типов:
1. тлеющий - при низких давлениях (до нескольких мм рт.ст.) -наблюдается в газосветных трубках (лампы дневного света) и газовых лазерах.
2. искровой - при нормальном давлении и высокой напряженности электрического поля (молния - сила тока до сотен тысяч ампер).
3 .коронный - при нормальном давлении в неоднородном электрическом поле (на острие, утечка энергии).
4. дуговой - большая плотность тока, малое напряжение между электродами (температура газа в канале дуги -5000-6000 градусов Цельсия); наблюдается в прожекторах, проекционной киноаппаратуре, сварка, ртутные лампы.
При достаточно низких температурах все вещества находятся в твердом состоянии. Нагревание вызывает переход вещества из твердого состояния в жидкое, а затем в газообразное.
Дальнейшее нагревание приводит к ионизации газа за счет столкновения быстро движущихся атомов и молекул. Вещество переходит в новое состояние.
Плазма - это четвертое агрегатное состояние вещества с высокой степенью ионизации за счет столкновения молекул на большой скорости при высокой температуре; встречается в природе: ионосфера - слабо ионизированная плазма, Солнце - полностью ионизированная плазма; искусственная плазма - в газоразрядных лампах. Плазма бывает:

Основные свойства плазмы: - высокая электропроводность - сильное взаимодействие с внешними электрическими и магнитными полями.
 99% вещества во Вселенной - плазма.
99% вещества во Вселенной - плазма.
Электронная эмиссия - явление испускания электронов из металлов при сообщении электронам энергии, равной или большей работы выхода.
Работа выхода электронов из металла - работа, которую нужно затратить для удаления электрона из металла в вакуум.
Работа выхода зависит от химической природы металлов и от чистоты их поверхности.
Работа выхода выражается в электрон-вольтах (эВ): 1 эВ равен работе, которую совершают силы поля при перемещении элементарного электрического заряда между точками разность потенциалов между которыми равна 1 В. Так как e = 1,6-10–19 Кл, то 1 эВ = 1,6-10–19 Дж.
1. Термоэлектронная эмиссия - испускание электронов нагретыми металлами. Пример использования - электронные лампы.
2. Фотоэлектронная эмиссия - эмиссия электронов из металла под действием электромагнитного излучения. Пример использования -фотодатчики.
3. Вторичная электронная эмиссия - испускание электронов поверхностью металлов, полупроводников или диэлектриков при бомбардировке их пучком электронов. Отношение числа вторичных электронов n 2 к числу первичных n 1, вызвавших эмиссию, называется коэффициентом вторичной электронной эмиссии σ = n2/n 1. Пример использования - фотоэлектронные умножители.
4. Автоэлектронная эмиссия - эмиссия электронов с поверхности металлов под действием сильного внешнего электрического поля.
Поиск по сайту: