 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Изотопы водорода. Дейтерий, протий и тритий
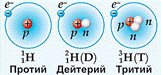
Водород имеет три изотопа с массовыми числами 1, 2 и 3.
Самый распространенный изотоп водорода – это обычный, привычный нам водород «1H» с ядром, состоящим из одного единственного протона. Нейтронов в этом ядре нет вовсе. По умолчанию, когда говорится «водород», имеют в виду именно такой изотоп, но когда мы говорим о разных изотопах водорода, то термин «водород» будет непонятен – то ли мы имеем в виду именно этот изотоп без нейтронов, то ли любой изотоп водорода. Поэтому для такого изотопа есть свое собственное название: «протий».
Еще один изотоп, который встречается в природе, это «дейтерий» - «2H». Ядро дейтерия состоит из одного протона и одного нейтрона. Содержание дейтерия в природе очень мало – около 0.01% от всех атомов водорода. Дейтерий еще обозначают для краткости буквой «D»
Третий изотоп – «тритий» - «3H». Его для краткости обозначают еще как «T»
В природе водород встречается в виде молекул H2 и HD в соотношении 3200:1.
Если взять разные химические элементы и посмотреть – насколько сильно отличаются физические свойства их изотопов, то мы увидим, что изотопы водорода отличаются друг от друга сильнее всего. Это можно легко объяснить, ведь в ядре водорода лишь один протон, и прибавление нейтрона к одному протону увеличивает массу ядра аж на 100%! То есть масса ядра меняется очень сильно, соответственно и физические свойства тоже сильно меняются.
Поиск по сайту: