 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Гідролази
До класу гідролаз відносять ферменти, що прискорюють реакції розщеплення (а інколи і синтезу) органічних сполук за участю води: R'R"+HOH –> R'H+R"OH.
Залежно від характеру субстрату, що піддається гідролізу, гідролази поділяють на ряд підкласів, серед яких найбільш важливі наступні:
§ естерази, що прискорюють реакції гідролізу складних ефірів;
§ глікозидази, що прискорюють реакції гідролізу глікозидів, у тому числі вуглеводів;
§ пептидгідролази, що прискорюють реакції гідролізу (а в особливих випадках і синтезу) білків, пептидів і інших сполук, що містять пептидні зв'язки;
§ гідролази, що діють на С—N-зв’язки, що відрізняються від пептидних (наприклад, амідази і т. п.).
Всього в складі гідролаз налічують майже 500 ферментів.
3.1. Естерази.
Естерази каталізують реакції гідролізу складних ефірів спиртів з органічними і неорганічними кислотами. Найважливішими підпідкласами естераз є гідролази ефірів карбонових кислот і фосфатази.
3.1.1. Карбоксиестерази.
Каталізують гідролітичне розщеплення триацилгліцеридів.
Серед карбоксиестераз виділяється фермент ліпаза, яка прискорює гідроліз зовнішніх, тобто α-складноефірних, зв'язків в молекулах триацилгліцеринів (жирів):
 |
де R1, R2, R3 – радикали жирних кислот.
В організмі тварин найактивніша ліпаза міститься у соці підшлункової залози та у печінці. У рослинах буває в розчинному та нерозчинному вигляді. Нерозчинна ліпаза міститься у насінні рицину, оптимум її дії відповідає рН 3,6. Ліпаза інших олійних культур, злакових, мікроорганізмів належить до розчинних, оптимум її дії відповідає рН 8. При підвищеній вологості, температурі ліпаза швидко розщепляє гліцериди, що веде до прогіркання продуктів.
3.1.2. Фосфоестерази (фосфатази).
Каталізують гідроліз фосфорних ефірів. Особливо широко поширені фосфатази, що діють на складні ефіри фосфорної кислоти і вуглеводів, наприклад глюкозо-1-фосфатаза:

Дія фосфатаз виявляється в широкому спектрі рН від 3 до 9. Більшість з них має широку субстратну специфічність.
Особливо важливі для регуляції процесів життєдіяльності протеїнфосфатази, що забезпечують відщеплення фосфату від фосфорильованих білків, внаслідок чого змінюється їх біологічна, зокрема ферментативна, активність.
3.1.3. Пектинестерази(пектази).
Каталізують гідроліз пектинових речовин. Пектаза розщепляє складно-ефірний зв’язок з утворенням вільної полігалактуронової кислоти та метилового спирту.
 |
3.2. Глікозидази(карбогідрази).
Глікозидази гідролітично розщеплюють глікозидні зв’язки в вуглеводах та інших глікозидах.
 R1-O-R1 + HOH R1OH + R1OH
R1-O-R1 + HOH R1OH + R1OH
де: R1 – залишок вуглеводу,
R2 – залишок вуглеводу або речовини невуглеводної природи (аглікон).
Залежно від того на який просторовий ізомер (α чи β) діє фермент, його відносять до α- або β-глікозидаз.
Таким чином, глікозидази мають яскраво виражену просторову специфічність. Окрім глікозидів, що містять в якості аглікону залишки одноатомних спиртів, субстратами, на які поширюється дія тих або інших глікозидаз, є оліго- і полісахариди.
Глікозидази поділяють на олігази, що гідролітично розщеплюють глікозидні зв’язки в олігосахаридах та поліази, що гідролізують полісахариди.
3.2. 1.Олігази.
Дисахариди, що виникають у ряді випадків при гідролізі полісахаридів (мальтоза при гідролізі крохмалю, целобіоза при гідролізі целюлози) або які існують в організмі у вільному стані (лактоза, сахароза, трегалоза і т. п.), гідролізуються при каталітичній дії α- і β-глікозидаз до індивідуальних моносахаридів.
Всі олігази, за винятком трегалази (α,α-трегалоза-глюкогідролаза), відрізняються широким спектром специфічності, прискорюючи гідроліз практично будь-яких глікозидів, що є похідними того або іншого α- або β-моносахариду.
Так, α-глюкозидаза прискорює реакцію гідролізу α-глюкозидів, у тому числі мальтози; β-глюкозидаза — β-глюкозидов, у тому числі целобіози; β-галактозидаза — β-галактозидов і серед них лактози і так далі
Олігази, окрім гідролазної активності, як правило, мають також глікозилтрансферазну дію і прискорюють процеси перенесення глікозильних залишків на ті або інші субстрати. Так, наприклад, целобіаза з аспергілу при дії на целобіозу утворює не лише β-D-глюкозу, але і трисахариди, тобто переносить залишок β-D-глюкози з одного дисахариду на іншій, що особливо яскраво проявляється на початку ферментативного процесу.
Зараз усе більше зміцнюється думка, що трансглікозування є одним з істотних елементів розпаду полісахаридів, олігосахаридів і дисахаридів, супутніх їх гідролізу.
§ a-Глюкозидаза (мальтаза)
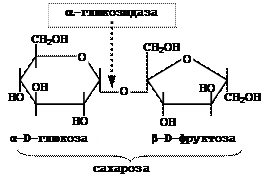
 Розщеплює a-глюкозидний зв’язок в дисахаридах (мальтозі) та глюкозидах (сахарозі):
Розщеплює a-глюкозидний зв’язок в дисахаридах (мальтозі) та глюкозидах (сахарозі):
| |||
| |||
Мальтаза розщеплює дисахарид мальтозу на 2 молекули a-глюкози. Мальтаза має велике значення в хлібопеченні. У цьому виробництві однією з біохімічних стадій, що обумовлюють якість хліба, є процес зброджування мальтози дріжджами. Останні повинні мати високу мальтазну активність. Цим вимогам задовольняють спеціальні хлібопекарні дріжджі;
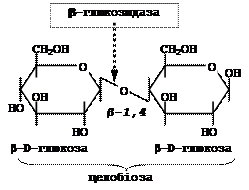
§ b-Глюкозидаза (целобіаза)
Розщеплює b-глюкозидні зв’язки в ди- та полісахаридах, а також в b-глюкозидах, наприклад, в целобіозі:
 |
§ a-Галактозидаза (мелібіаза)
Розщеплює a-галактозидний зв’язок в мелібіозі та рафінозі. Цей фермент має важливе промислове значення. Спиртове виробництво, що використовує меласу, несе суттєві збитки із-за того, що рафіноза, що міститься в цій сировині, не зброджується повністю дріжджами. Дріжджі містять b-фруктозидазу і не виробляють a-галактозидазу.
Внаслідок цього вони відщеплюють від рафінози лише фруктозу. Частина молекули, що залишилася (мелібіоза) не гідролізується і не піддається подальшому перетворенню на спирт.
 Це може бути вирішено двома шляхами: отриманням спеціальних рас дріжджів, що мають a-галактозидазну активність чи застосування ферментного препарату a-галактозидази.
Це може бути вирішено двома шляхами: отриманням спеціальних рас дріжджів, що мають a-галактозидазну активність чи застосування ферментного препарату a-галактозидази.
§ b-Галактозидаза (лактаза)
Каталізує гідролітичне розщеплення b-галактозидного зв’язку в лактозі:
 |
Цей фермент, окрім виконання важливої ролі в живому організмі застосовується в промисловості. При виготовленні продуктів з молока (морозиво тощо) для покращення їх смакових та інших якостей доцільним є розщеплення лактози молока на моноцукри за допомогою b-галактозидази;
b-Фруктозидаза (сахараза, інвертаза)
Розщеплює b-фруктозидний зв’язок в сахарозі та рафінозі:
 |
Сахараза каталізує розщеплення сахарози на глюкозу та фруктозу. Цей фермент відіграє велику роль в організмі людини та тварин, оскільки багато продуктів, які вони споживають, містять сахарозу. Необхідний і для багатьох промислових м/о, оскільки цукромістка сировина (меляса тощо) є найбільш поширеною сировиною мікробіологічної промисловості. Препарат інвертази (інвертин) застосовують в кондитерській промисловості.
Деякі глікозидази каталізують також реакції перенесення глікозильних залишків на різні субстрати, тобто є трансглікозидазами, тобто проявляють глікозилтрансферазну дію. Так, целобіоза утворює не тільки β-D-глюкозу, але й трисахариди, тобто переносить залишок β-D-глюкози з одного дисахариду на інший.
3.2. 2.Поліази.
§ Амілази - група ферментів, що гідролізують крохмаль. Встановлена наявність трьох амілаз.
Характерна особливість амілаз — відсутність абсолютної специфічності дії. При їх участі гідролізуються різні сполуки: амілоза, амілопектин, глікоген, олігосахариди і подібні до них речовини, що побудовані із залишків α-D-глюкопіранози і містять в молекулах α-1,4- і α-1,6-глюкозидні зв'язки.
Мабуть, всі амілази є металопротеїнами (містять Zn2+ і Са2+), деякі з них мультимери; вважають, що іони металів сприяють становленню молекули мультимеру з протомерів.
α-Амілаза (тваринна амілаза, декстриногенамілаза, α-1,4-глюкан-4-глюканогідролаза).
α-Амілаза знайдена у всіх рослинних і тваринних організмах; в організмі тварин її міститься більше, ніж у рослинах. Присутня у слині, травному соці, що виділяється підшлунковою залозою, у пророслому зерні пшениці, жита, ячменю.
Прискорює гідроліз α-1,4-глікозидних зв'язків в середині молекули крохмалю невпорядковано, внаслідок чого спочатку виникають олігосахариди, які теж підпадають під дію α-амілази, якщо вони містять три або більше залишків α-D-глюкози.
Таким чином, α-амілаза є ендоамілазою, оскільки вона атакує внутрішні глікозидні зв'язки в молекулі крохмалю і для її дії не має значення близькість або віддаленість нередукуючих кінцевих залишків поліглікозидних фрагментів молекули крохмалю. Окрім крохмалю вона гідролізує також глікоген.
a-Амілаза гідролізує крохмаль не повністю, утворюючи продукти з невеликою кількістю залишків глюкози - низькомолекулярні декстрини, а також невелику кількість мальтози та глюкози.

В результаті дії α-амілази утворюються продукти неповного гідролізу крохмалю – α-декстрини.
Якщо дія α-амілази поширюється на спіралізовану ділянку молекули крохмалю або молекули амілози, то гідроліз α-1,4-глікозидних зв'язків здійснюється латерально, уздовж одного боку спіралізованого α-1,4-глюкану. Оскільки кожен виток спіралі містить 6—7 залишків α-D-глюкопіранози, в результаті гідролізу утворюються гекса- або гептасахариди.
Кінцевим продуктом гідролізу крохмалю за допомогою α-амілази є мальтоза, оскільки в дисахаридах α-1,4-зв'язки під дією α-амілази не гідролізуються.
Гідроліз крохмалю за допомогою α-амілази у всіх випадках призводить до утворення α-форми мальтози, звідки веде своє походження назву ферменту.
Теоретично при дії α-амілази на амілозу про повному гідролізі можна отримати до 85% мальтози і 15% глюкози, при дії на амілопектин – до 70% мальтози, 10% ізомальтози і 20% глюкози.
β-Амілаза (рослинна амілаза, сахарогенамілаза, α-1,4-глюкан-мальтогідролаза).
β-Амілаза характерна лише для вищих рослин (зерні пшениці, жита, ячменю, соєвих бобах). В натуральному зерні b-амілаза знаходиться у вільному стані, а a-амілаза зв’язана з білками і тому неактивна. Звільняється вона при проростанні зерна.
Прискорює реакцію гідролізу крохмалю за α-1,4-глюкозидними зв'язками, послідовно відщеплюючи залишки мальтози, починаючи з нередукуючого кінця молекули крохмалю; її дія припиняється в точках розгалуження в молекулі крохмалю:

Мальтоза, що звільняється при гідролізі крохмалю під дією β-амілази, виходить у β-формі:

Утворення β-форми мальтози, тобто зміна просторовій конфігурації молекули за місцем глікозидного гідроксилу, що утворюється, при 1-му вуглецевому атомі залишку глюкози, відбувається у момент гідролізу α-глікозидного зв'язку. Відповідно до цього фермент і отримав свою назву.
b-Амілаза практично не гідролізує нативний крохмаль, тоді як клейстеризований крохмаль гідролізує до мальтози в b-конфігурації та високомолекулярних b-декстринів.
 |
b-Декстрини містять значну кількість a-1-6-зв’язків, тому їх гідроліз припиняється на передостанньому a-1-4-зв’язку, який межує з a-1-6-зв’язком.
Теоретично при дії β-амілази на амілозу про повному гідролізі можна отримати до 100% мальтози, при дії на амілопектин – до 60% мальтози, 40% β-амілодекстрину.
Якщо в середовищі присутня і a-амілаза, то вона розщепляє крупні декстрини, забезпечуючи можливість подальшої дії b-амілази. Присутність a-амілази посилює активність b-амілази. Отже, активність двох амілаз при їх спільній дії вище суми активностей кожної з них окремо, тобто має місце синергічна дія двох амілаз.
Розрізняються a- та b-амілази і чутливістю до температури та рН середовища.
a-Амілаза більш стійка до підвищеної температури, але чутлива до підкислення рН середовища. Це використовується в хлібопекарній промисловості, де продукти дії a-амілази - низькомолекулярні декстрини - знижують якість хліба.
Оскільки у пророслому зерні пшениці та жита міститься активна a-амілаза, то в процесі бродіння тіста, яке замісили з борошна пророслого зерна, накопичується значна кількість декстринів, що надають хлібу низьку еластичність, недостатню пористість, неприємний смак.
Оскільки a-амілаза чутлива до зниження кислотності, то тісто замішують на рідких дріжджах або молочнокислих заквасках. Це забезпечує накопичення в тісті підвищеної кількості молочної кислоти, що пригнічує дію a-амілази.
Але амілаза має і позитивне значення у хлібопекарській, пивоварній, спиртовій, текстильній промисловості. Бродіння тіста та накопичення в ньому СО2, що розрихлює його та надає хлібу рівномірну пористість та об’єм, залежать від присутності у тісті заброджених дріжджами сахарів, що, в свою чергу, залежить від швидкості накопичення мальтози під впливом амілази на крохмаль. Хоча надто енергійна дія a-амілази пророслого зерна погіршує якість хліба.
Солод, що застосовується при виготовленні пива та оцукрюванню заторів у спиртовій промисловості, є джерелом активної амілази, що каталізує перетворення крохмалю в мальтозу.
При спільній дії a- та b-амілаз крохмаль гідролізується на 85-95 %. Негідролізований крохмаль представляє собою залишки із зв’язками 1–6 і так звані аномальні структури, на які не діють ці ферменти. Розщеплення α-1,6-глікозидних зв’язків здійснюють ферменти оліго-1,6-глюкозидаза та амілопектин-1,6-глюкозидаза.
Глюкоамілаза, або γ-амілаза (α-1,4-глюканглюкогідролаза),
Глюкоамілаза поширена повсюдно; вона відкрита Е. Л. Розенфельд (1959) в тканинах тварин, де яскраво представлена, як, втім, і в пліснявих грибах.
Глюкоамілаза прискорює реакцію гідролізу α-1,4-глюкозидних зв'язків з нередукуючих кінців (що не містятьть вільної альдегідної групи або глікозидного гідроксилу) молекули крохмалю, послідовно відщеплюючи залишки a-D-глюкози, а також розщеплює a-1,6-зв’язок тільки в тому випадку, коли за ним йде a-1,4-зв’язок.
Утворюється переважно глюкоза та невелика кількість декстринів. За допомогою цього ферменту отримують глюкозну патоку та кристалічну глюкозу.
 |
Крім того, прискорює реакцію гідролізу α-1,4-глюкозидних зв'язків в молекулах олігосахаридів і навіть дисахаридів (наприклад, мальтози),
Аміло-1,6-глюкозидаза прискорює реакцію гідролізу α-1,6-глікозидних зв'язків в молекулі крохмалю (амілопектину), розщеплюючи, таким чином, його молекулу в точках розгалудження поліглюкозидного ланцюга і утворюючи олігосахариди з тим або іншим числом залишків α-D-глюкози в них, залежно від довжини ланцюга, що відщеплюється.
Аміло-1,6-глюкозидаза характерна для тваринних тканин. Проте це не означає, що її немає на рослинному світі: у рослин цей же фермент називають R-ензимом, а у мікроорганізмів — ізоамілазою.

Аналогічно крохмалю і глікогену гідролізуються інші природні полісахариди:
§ целюлоза — за участю целюлазного комплексу ферментів (складається з ендо-1,4-β-глюканази, екзоцелобіогідролази, целобіази і екзо-1,4-β-глюкогідролази),
§ інулін — за допомогою інулінази (2,1-β-D-фруктанфруктаногідролази),
§ хітин — хітинази,
§ ксилан — ксиланази,
§ гіалуронова кислота — гіалуронідази,
§ пектинові речовини — комплексу пектинолітичних ферментів (пектинестерази, полігалактуронази і ін.) і т.п.
У всіх випадках полісахариди розпадаються до відповідних моносахаридів або їх похідних (іноді до дисахаридів), з яких складені молекули вказаних полісахаридів. Деякі з гідролаз, перерахованих вище, широко поширені в природі, інші (целюлаза, інуліназа) — властиві лише певним видам рослин, тварин і мікроорганізмів.
Особливу увагу привертають целюлази, хітинази, 1,3- і 1,6-β-глюканази і ліхенази (гідролізують гетерополісахариди з переміжними 1,3- і 1,4-глікозидними зв'язками), оскільки вони розкладають рослинні і мікробні залишки, які є екологічно небезпечними відходами виробництва, дозволяючи при цьому отримувати глюкозу і N-ацетилглюкозамин.
Деякі з них, наприклад, хітинази з Bacillus cereus прискорюють реакцію гідролізу хітину при рН=4 і t = 60°С до хітобіози, але не до N-ацетил-β-D-глюкозаміну.
Полігалактуроназа (пектиназа) здійснює гідролітичне розщеплення α-1,4-глікозидних зв’язків в пектинових речовинах. Діє тільки на глікозидні зв’язки, утворені залишкам галактуронової кислоти. Якщо в утворенні глікозидного зв’язку приймає участь метоксильована галактуронова кислота, то цей фермент не подіє на такий зв’язок.
 |
Аналогічно крохмалю і глікогену гідролізуються інші природні полісахариди:
§ целюлоза — за участю целюлазного комплексу ферментів (складається з ендо-1,4-b-глюканази, екзоцелобіогідролази, целобіази і екзо-1,4-b-глюкогідролази),
§ інулін — за допомогою інулінази (2,1-b-D-фруктанфруктаногідролази),
§ хітин — хітинази,
§ ксилан — ксиланази,
§ гіалуронова кислота — гіалуронідази,
§ пектинові речовини — комплексу пектинолітичних ферментів (пектинестерази, полігалактуронази і ін.) і т.п.
У всіх випадках полісахариди розпадаються до відповідних моносахаридів або їх похідних (інколи до дисахаридів), з яких складаються молекули вказаних полісахаридів.
Деякі з гідролаз, перерахованих вище, широко розповсюджені в природі, інші (целюлаза, інуліназа) — властиві лише певним видам рослин, тварин і мікроорганізмів.
Особливу увагу привертають целюлази, хітинази, 1,3- і 1,6-b-глюканази і ліхенази (гідролізують гетерополісахариди з 1,3- і 1,4-глікозидними зв'язками, що переміжаються), оскільки вони розкладають рослинні і мікробні залишки, що є екологічно небезпечними відходами виробництва, дозволяючи при цьому отримувати глюкозу і N-ацетилглюкозамін.
Деякі з них, наприклад, хітинази з Bacillus cereus прискорюють реакцію гідролізу хітину при рН=4 і t = 60°С до хітобіози, але не до N-ацетил-b-D-глюкозаміну.
3. Пептидгідролази(протеази).
Ферменти цього підкласу прискорюють гідроліз пептидних зв'язків в білках і пептидах, а за певних умов також і утворення пептидних зв'язків, хоча цей шлях синтезу білка не є фізіологічним.
 Хімізм процесу гідролізу білків і пептидів за участю пептидгідролаз можна виразити наступною схемою:
Хімізм процесу гідролізу білків і пептидів за участю пептидгідролаз можна виразити наступною схемою:
Серед пептидгідролаз розрізняють:
§ протеїнази, що каталізують гідроліз невеликого числа внутрішніх пептидних зв'язків в білковій молекулі, внаслідок чого остання розпадається до пептидів; отже вони є ендопептидазами,
§ пептидази, що забезпечують відщеплення від пептидного ланцюга вільних амінокислот; отже вони є екзопептидазами.
Поиск по сайту: