 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Основные формулы
Состояние системы задается термодинамическими параметрами (параметры состояния) – совокупность физических величин, характеризующих свойства термодинамической системы. Важнейшими параметрами состояния системы являются плотность тела (или величина обратная плотности – удельный объем), давление и температура.
Плотность (r) – масса вещества в единице объема
 . (3.1)
. (3.1)
Давление (Р) – сила F, действующая на единицу площади S поверхности тела, направленная по нормали к этой поверхности
 . (3.2)
. (3.2)
Эмпирическая температура (t) – мера отклонения тел от состояния теплового равновесия с тающим льдом, находящимся под давлением в одну физическую атмосферу. В качестве единицы измерения принят 1 градус Цельсия (1 оС), который определен тем условием, что тающему под атмосферным давлением льду приписывают 0 оС, а кипению воды при том же давлении – 100 оС, соответственно.
Различие между абсолютной и эмпирической температурой заключается, прежде всего, в том, что абсолютная температура отсчитывается от нижнего температурного предела – абсолютного нуля, который лежит ниже температуры таяния льда на 273,16о, то есть
| T = t + 273,16. | (3.3) |
Абсолютным нулем (Т=0 К) называется температура, при которой прекращается тепловое движение молекул. Анализ различных процессов показывает, что 0 К недостижим, хотя приближение к нему сколь угодно близко возможно.
Основным уравнением кинетической теории газов называется соотношение, связывающее давление (величину, измеряемую на опыте) со скоростью или кинетической энергией молекулы газа
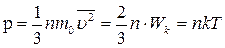 . .
| (3.4) |
где W k – суммарная кинетическая энергия поступательного движения всех молекул, n – концентрация молекул.
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа
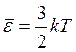 , ,
| (3.5) |
где k - постоянная Больцмана, выражающая соотношение между единицей энергии и единицей температуры: k =1,38·10-23 Дж/К.
Средняя квадратичная скорость поступательного движения молекул
 . .
| (3.6) |
Согласно закону Дальтона давление смеси идеальных газов равно сумме парциальных давлений 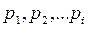 входящих в нее газов
входящих в нее газов
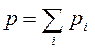 . .
| (3.7) |
Парциальное давление - давление, которое оказывал бы газ, входящий в состав газовой смеси, если бы он один занимал весь объем, равный объему смеси при той же температуре.
Изопроцессами называются термодинамические процессы, происходящие в системе с постоянной массой при каком-либо одном постоянном параметре состояния.
1.
 |
Изотермический процесс.
Закон Бойля-Мариотта: для данной массы газа, при постоянной температуре, произведение давления газа на объем остается величиной постоянной, то есть при T = const и m = const (см. рис. 3.1):
| P×V = const | (3.8,а) |
или
| P 1 ×V 1 = P 2 ×V 2. | (3.8,б) |
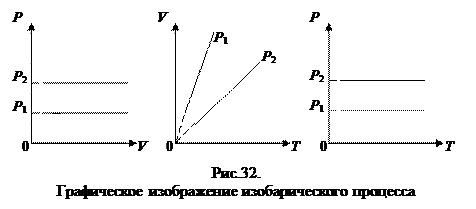
2. Изобарный процесс.
Закон Гей - Люссака: для данной массы газа, при постоянном давлении, объем линейно возрастает с увеличением температуры, то есть при Р = const и m = const (см. рис. 3.2):

| (3.9,а) |
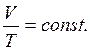
| (3.9,б) |
 |
или
3. Изохорический процесс.
Закон Шарля: для данной массы газа, при постоянном объеме, давление линейно возрастает с увеличением температуры, то есть при V = const и m = const (см. рис. 3.3):
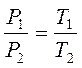
| (3.10,а) |
или

| (3.10,б) |
 |
1 моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде массой 0,012 кг.
Моли любых газов при одинаковых температурах и давлении занимают одинаковые объемы - закон Авогадро. При нормальных условиях (р =1,013·105 Па, Т =273, 15 К) этот объем равен 22,41·10-3 м3/моль.
Число молекул (структурных единиц) в 1 моле равно числу Авогадро: NA=6,02·1023моль-1.
уравнение Менделеева-Клапейрона:
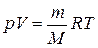 , или
, или 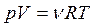 (3.11)
(3.11)
где М - молярная масса газа,  - количество вещества, R =8,31
- количество вещества, R =8,31 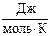 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Если N - общее число молекул газа, dN - число молекул, скорости которых заключены в интервале от  до
до  +d
+d 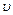 , то закон распределения Максвелла запишется в виде:
, то закон распределения Максвелла запишется в виде:
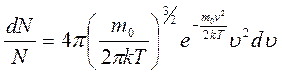
| (3.12) |
функция распределения 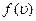 указывает долю молекул d N / N, обладающих скоростями, лежащими в интервале dυ около значения скорости υ:
указывает долю молекул d N / N, обладающих скоростями, лежащими в интервале dυ около значения скорости υ:
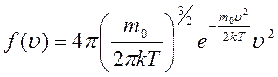
| (3.13) |
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью:
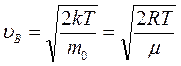 . (3.14)
. (3.14)
Если выразить скорости молекул не в обычных единицах, а в относительных, приняв за единицу скорости наиболее вероятную скорость молекул, то распределение Максвелла принимает вид:
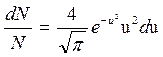 , ,
| (3.15) |
где u= 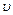 /
/ 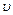 в – относительная скорость молекул.
в – относительная скорость молекул.
Средняя скорость молекулы ` 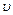 (средняя арифметическая скорость) определяется:
(средняя арифметическая скорость) определяется:
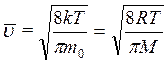 . .
| (3.16) |
Зависимость давления атмосферы от высоты над уровнем моря при постоянной температуре называют барометрической формулой.
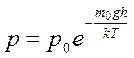 . .
| (3.17) |
З акон распределения концентраций по высоте:
 , ,
| (3.18) |
где n и n 0 – концентрация молекул на высоте h и h0=0.
Под внутренней энергией U в термодинамике понимают энергию теплового движения частиц, образующих систему, и потенциальную энергию их взаимного положения:

| (3.19) |
где i – число степеней свободы.
Первое начало термодинамики выражает закон сохранения энергии для тех макроскопических явлений, в которых одним из существенных параметров, определяющих состояние тел, является температура. Существует две формулировки первого начала термодинамики:
1) приращение внутренней энергии системы всегда равно сумме совершаемой над системой работы А' и количества сообщенной системе теплоты Q:
| DU = Q + А’ | (3.20,а) |
2) теплота, сообщенная системе в процессе изменения ее состояния, расходуется на изменение ее внутренней энергии и на совершение работы против внешних сил:
| Q=DU + А | (3.21,б) |
Если рассматриваемый процесс разбить на ряд элементарных процессов, каждый из которых соответствует весьма малому изменению параметров системы, то п ервый закон термодинамики для элементарного процесса в дифференциальном виде:
| δQ = dU+δA, | (3.22) |
где dU – малое изменение внутренней энергии; δ Q – элементарное количество теплоты; δ А – элементарная работа.
Работа расширения, совершаемая при конечных изменениях объема:
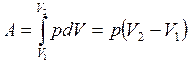 (3.23)
(3.23)
Теплоемкостью системы тел (тела) называется физическая величина, равная отношению количества теплоты dQ, которое нужно затратить для нагревания системы тел (тела), к изменению температуры dТ, характеризующей это нагревание:
 . [C]=Дж/К. (3.24)
. [C]=Дж/К. (3.24)
Удельной теплоемкостью вещества с называется скалярная величина, равная отношению теплоемкости однородного тела С к его массе:
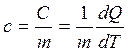 . [ c ]= Дж/(кг.К) (3.25)
. [ c ]= Дж/(кг.К) (3.25)
Молярной теплоемкостью называется физическая величина, численно равная отношению теплоемкости системы С к количеству вещества n, содержащегося в ней:
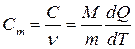 . [Cm]=Дж/(моль.К) (3.26)
. [Cm]=Дж/(моль.К) (3.26)
Различают молярные теплоемкости при постоянном объеме и постоянном давлении (табл.4 приложения):
 , , 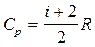 . .
| (3.27) |
Уравнение, связывающее молярные теплоемкости при постоянном давлении и постоянном объеме имеет вид (уравнение Майера):
Cp – CV= R. (3.28)
Первое начало термодинамики при изохорическом процессе (V =const; dV=0, dA=pdV=0): 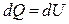 – теплота, сообщаемая системе при изохорическом процессе, идет на изменение внутренней энергии.
– теплота, сообщаемая системе при изохорическом процессе, идет на изменение внутренней энергии.
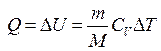 , (3.29)
, (3.29)
При этом работа не совершается.
Первое начало термодинамики при изобарическом процессе (p=const):
 . (3.30)
. (3.30)
Работа изобарного расширения равна
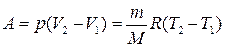 . (3.31)
. (3.31)
Первое начало термодинамики при изотермическом процессе (Т =const; dT= 0; 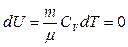 ):
): 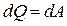 – теплота, сообщаемая системе при изотермическом процессе, идет на работу против внешних сил:
– теплота, сообщаемая системе при изотермическом процессе, идет на работу против внешних сил:
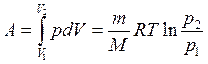 (3.32)
(3.32)
Адиабатным называется процесс, протекающий без теплообмена с внешней средой: dQ=0.
Из первого закона термодинамики:
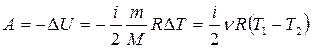 ,
,
то есть работа при адиабатическом процессе совершается за счет убыли внутренней энергии.
Уравнения Пуассона (уравнения состояния для адиабатического процесса):
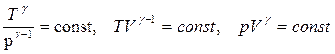 . (3.33)
. (3.33)
Величина g - показатель адиабаты - определяется числом и характером степеней свободы молекулы (табл.4 приложения):
 . (3.34)
. (3.34)
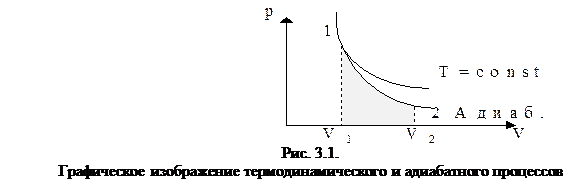
При сопоставлении адиабатного и изотермического процессов (рис. 3.1) видно, что адиабата проходит более круто, чем изотерма.
Политропным называется термодинамический процесс, в котором теплоемкость тела постоянна: С =const.
Уравнения политропного процесса в идеальном газе:
pVn = cons t, ТVn-1 = const, (3.35)
где  – показатель политропы, зависящий от удельной теплоемкости газа.
– показатель политропы, зависящий от удельной теплоемкости газа.
Существует несколько формулировок второго начала термодинамики:
1. формулировка Клаузиуса: Невозможен процесс, единственным конечным результатом которого является передача энергии в форме теплоты от менее нагретого тела к более нагретому.
2. формулировка Томсона (Кельвина): Невозможен процесс, единственным конечным результатом которого является превращение всей теплоты, полученной от некоторого тела, в эквивалентную ей работу.
Круговой процесс – это совокупность термодинамических процессов, в результате которых система возвращается в исходное состояние. На диаграммах состояния круговые процессы изображаются замкнутыми линиями.
Прямым циклом называется круговой процесс, в котором система совершает положительную работу 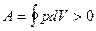 . Примером прямого цикла является цикл, совершаемый рабочим телом в тепловом двигателе.
. Примером прямого цикла является цикл, совершаемый рабочим телом в тепловом двигателе.
Обратным циклом называется круговой процесс, в котором система совершает отрицательную работу  (например, цикл рабочего тела в холодильной установке).
(например, цикл рабочего тела в холодильной установке).
Коэффициент полезного действия (КПД) тепловой машины - это отношение совершаемой за цикл работы А к количеству теплоты, полученному рабочим телом от нагревателя Q 1:
 , (3.36)
, (3.36)
где Q1 – количество теплоты, полученное рабочим веществом, Q2 – количество теплоты, отданное рабочим веществом холодильнику.
 |
Циклом Карно называется круговой процесс, при котором выполненная системой работа максимальна. Прямой цикл Карно состоит из четырех последовательных обратимых процессов: изотермического расширения (1®2) при температуре Т1, адиабатического расширения и сжатий (2®3, изотермического сжатия (3®4) при температуре Т2 и адиабатического сжатия (4®1) (рис.3.3.).
Машина, совершающая цикл Карно, называется идеальной тепловой машиной.
Термический коэффициент полезного действия прямого цикла Карно, совершаемого идеальным газом:
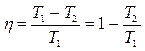 . (3.37)
. (3.37)
где Т 1 и T 2 – значения температуры нагревателя и холодильника, участвующих в осуществлении рассматриваемого цикла.
Функция состояния S, дифференциал которой
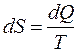 (3.38)
(3.38)
называется энтропией. Здесь dQ –бесконечно малое количество теплоты, сообщенное системе в элементарном обратимом процессе.
Изменение энтропии в любом обратимом процессе, переводящем систему из состояния 1 в состояние 2, равно приведенному количеству теплоты, переданному системе в этом процессе
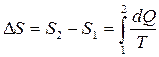 , (3.39)
, (3.39)
где S1 и S2 – значения энтропии в состояниях 1 и 2, DS – изменение энтропии в течение обратимого процесса.
Термодинамическая вероятность системы W- это число всевозможных распределений частиц по координатам и скоростям, соответствующих данному термодинамическому состоянию.
Термодинамическая вероятность и энтропия связаны соотношением (формула Больцмана):
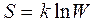 (3.40)
(3.40)
При нарушении равновесия система стремится вернуться в равновесное состояние. Этот процесс сопровождается возрастанием энтропии и, следовательно, необратим. Нарушение равновесия сопровождается переносом массы (диффузия), импульса (внутреннее трение) или энергии (теплопроводность). Эти процессы называются явлениями переноса. Следовательно, явления переноса представляют собой необратимые процессы.
Средней длиной свободного пробега молекул `l называется среднее расстояние, которое молекула проходит без столкновений:

| (3.41) |
Число столкновений, испытываемых молекулой в единицу времени, может быть различным. Поэтому следует говорить о среднем значении этой величины 
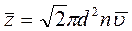 , (3.42)
, (3.42)
где n – концентрация молекул.
Средняя длина свободного пробега  и среднее число столкновений в единицу времени
и среднее число столкновений в единицу времени  связаны между собой уравнением:
связаны между собой уравнением:
 , (3.43)
, (3.43)
где 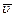 – средняя арифметическая скорость.
– средняя арифметическая скорость.
Коэффициент диффузии – это масса, переносимая в единицу времени через единичную площадку в направлении нормали к этой площадке в сторону убывания плотности компонента при градиенте плотности, равном единице
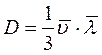 . (3.44)
. (3.44)
коэффициентом внутреннего трения (коэффициентом вязкости) численно равен импульсу, переносимому в единицу времени через единичную площадку при единичном градиенте скорости:
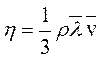 . (3.45)
. (3.45)
К оэффициент теплопроводности, численно равный количеству теплоты, переносимому в единицу времени через единичную площадку при единичном градиенте температуры:
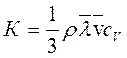 ([ К ]=Вт/м.К), (3.46)
([ К ]=Вт/м.К), (3.46)
где ρ – плотность газов.
3.2. примеры решения задач по теме:
«молекулярная физика и термодинамика»
Задача 3.1. Определить молярную массу смеси кислорода массой m1 = 25 г и азота массой m2 = 75 г.
| Дано: m1 = 25 г = 25·10-3 кг m2 = 75 г = 75·10-3 кг | Решение:
Молярная масса смеси М есть отношение массы смеси m к количеству вещества смеси ν:
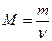 . (1)
Масса смеси равна сумме масс компонентов: . (1)
Масса смеси равна сумме масс компонентов:
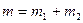 . (2) . (2)
|
| М =? |
Количество вещества смеси равно сумме количества компонентов:
 . (3)
. (3)
Подставив в формулу (1) выражения (2) и (3) и преобразовав, получим:
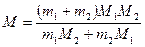 .
.
Молярные массы кислорода М1 и азота М2 определяем из таблицы Менделеева:
М1=32·10-3 кг/моль и М2=28·10-3 кг/моль
Вычисления:
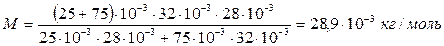 .
.
Ответ: 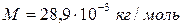
Задача 3.2. Два баллона соединены трубкой с закрытым клапаном, объемом которой можно пренебречь. В баллоне объемом 0,02 м3 находится газ под давлением 1,6×104 Па, а в баллоне объемом 0,06 м3 - тот же газ под давлением 1,2×104 Па. Какое давление установится в баллонах, если открыть кран? Температура газа остается постоянной.
| Дано: V 1 = 0,02 м3 р 1 = 1,6×104 Па V 2 = 0,06 м3 р 2 = 1,2×104 Па Т = const. | Решение: Газ занимает весь предоставленный ему объем. После того, как клапан будет открыт, часть газа из одного сосуда будет переходить в другой до тех пор, пока давление в обоих сосудах не уравняется. Объем, который будет занимать газы, равен сумме объемов сосудов V = V 1 + V 2, где V 1 - объем первого сосуда, V 2 - объем второго сосуда. Давление, установившееся в сосудах, согласно закону Дальтона, р = р 1' + р 2' (1) |
| р -? |
где р 1' - давление газа первого сосуда, р 2' - давление газа второго сосуда.
По условию задачи температура газа остается неизменной, следовательно, согласно закону Бойля-Мариотта для двух состояний газа можно записать:
 , (2)
, (2)
Решая полученную систему уравнений
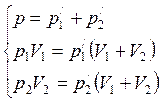
получим
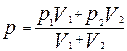
Проверить единицы физических величин слева и справа от знака равенства

Вычисления:
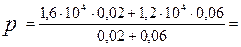 1,3×104 Па.
1,3×104 Па.
Ответ: р = 1,3×104 Па.
Задача 3.3. Баллон содержит m 1= 80 г кислорода и m 2=320 г аргона. Давление смеси р =1 МПа, температура Т =300 К. Принимая данные газы за идеальные, определить объем V баллона.
| Дано: m1 = 80 г=0,08 кг m2 = 320 г=0,32 кг р = 1 МПа =1×106 Па Т = 300 К. | Решение:
По уравнению Менделеева - Клайперона, парциальные давления р1 кислорода и р2 аргона выражаются формулами:
 , ,  (1)
где М1 и М2 - молярная масса кислорода и аргона, R =8,31 (1)
где М1 и М2 - молярная масса кислорода и аргона, R =8,31  - универсальная газовая постоянная. - универсальная газовая постоянная.
|
| V-? |
По закону Дальтона давление смеси равно сумме парциальных давлений газов, входящих в состав смеси:
р = р 1 + р 2 (2)
Подставив уравнение (1) в уравнение (2), получим:
 .
.
из последнего выражения найдем объем баллона:
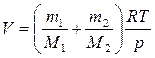 ,
,
где М1=32·10-3 кг/моль – молярная масса кислорода, М2=40·10-3 кг/моль – молярная масса аргона (из таблицы Менделеева).
Вычисления:
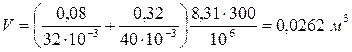
Ответ: V=0,0262 м3
Задача 3.4. Найти среднюю кинетическую энергию  вращательного движения одной молекулы кислорода при температуре Т=350 К, а также кинетическую энергию Е к вращательного движения всех молекул кислорода массой m =4 г.
вращательного движения одной молекулы кислорода при температуре Т=350 К, а также кинетическую энергию Е к вращательного движения всех молекул кислорода массой m =4 г.
| Дано: m = 4 г = 4·10-3 кг Т = 350 К. | Решение:
На каждую степень свободы молекулы газа приходится одинаковая средняя энергия:
 ,
где k =1,38·10-23 Дж/К - постоянная Больцмана, Т – абсолютная температура. ,
где k =1,38·10-23 Дж/К - постоянная Больцмана, Т – абсолютная температура.
|
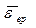 -?
Е к -? -?
Е к -?
|
Так как вращательному движению двухатомной молекулы (молекула кислорода – двухатомная) соответствуют две степени свободы, то средняя энергия вращательного движения молекулы кислорода:

Кинетическая энергия вращательного движения всех молекул газа:
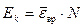 . (2)
. (2)
Число всех молекул газа найдем из формулы количества вещества:
 , (3)
, (3)
где NA=6,02·1023моль-1 - число Авогадро, ν - количество вещества, М=32·10-3 кг/моль – молярная масса кислорода.
Подставляя уравнение (3) в формулу (2), получим:
 .
.
Вычисления:
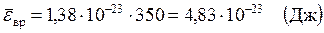

Ответ: 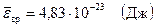 ,
, 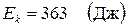
Задача 3.5. Некоторое количество гелия расширяется: сначала адиабатно, а затем изобарно. Конечная температура газа равна начальной. При адиабатном расширении газ совершил работу, равную 4,5 кДж. Какова работа газа за весь процесс?
| Дано: V 2 = 3 V 1 А 12= 4,5·10-3 Дж р = const Q = 0 Т 3 = Т 1 | Решение:
Изобразим графически процессы, происходящие с газом.

|
| А 123-? |
На графике процесс 1-2 является адиабатным, т.е Q = 0; процесс 2 – 3 - изобарный (р = const). Так как начальные и конечные температуры равны (по условию задачи), то процесс 3 – 1 будет изотермическим (Т=const).
полная работа равна сумме работ на каждом из участков:
А123 = А12 + А23 (1)
По первому закону термодинамики для адиабатного процесса, учитывая, что газ одноатомный работа А12 газа на участке 1-2, равна изменению внутренней энергии  , взятой со знаком «минус»:
, взятой со знаком «минус»:
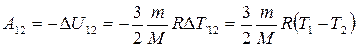 , (2)
, (2)
где М = 4·10-3 кг/моль – молярная масса гелия, Т1 и Т2 – абсолютные температуры газа в состоянии 1 и 2 соответственно, R =8,31 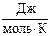 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Работа изобарного расширения, учитывая, что Т 3 = Т 1 равна
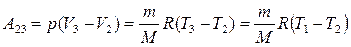 . (3)
. (3)
Решая совместно полученные уравнения
А123 = А12 + А23
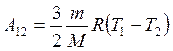

Получим
А123 =  А12.
А12.
Вычисления:
А123 =  ·4,5·103=7500 Дж
·4,5·103=7500 Дж
Ответ: А123 = 7500 Дж.
Задача 3.6. Коэффициент диффузии D и вязкость η водорода при некоторых условиях равны D = 1,42·10-4 м2/си η = 8,5 мкПа·с. Диаметр молекул водорода σ = 0,3 нм. Найти число n молекул водорода в единице объема.
 Дано:
D = 1,42·10-4 м2/с
η = 8,5 ·10-6 Па·с
σ = 0,3·10-9 м Дано:
D = 1,42·10-4 м2/с
η = 8,5 ·10-6 Па·с
σ = 0,3·10-9 м
| Решение:
Коэффициент диффузии D и коэффициент вязкости η, определяются уравнениями:

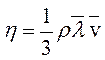 где
где  - средняя арифметическая скорость молекул; - средняя арифметическая скорость молекул;
|
| Найти: n -? |
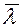 - средняя длина свободного пробега молекул; ρ – плотность газа.
- средняя длина свободного пробега молекул; ρ – плотность газа.
Количество вещества:
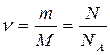 ,
,
где М=2·10-3 кг/моль – молярная масса водорода; m – масса газа; NA=6,02·1023 моль-1 - число Авогадро, ν - количество вещества.
Концентрация молекул водорода n определяется числом молекул N в единице объема V:
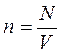
Решая совместно систему уравнений:
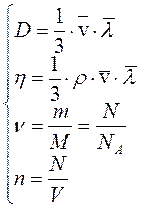
можно получить:

Вычисления:
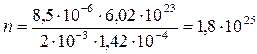 м-3
м-3
Ответ: n = 1,8·1025 м-3
задача 3.7. Тепловая машина работает по обратимому циклу Карно. Температура теплоотдатчика Т1 = 500 К. Определить термический КПД цикла и температуру Т2 теплоприёмника тепловой машины, если за счёт каждого килоджоуля теплоты, полученной от теплоотдатчика, машина совершает работу А= 350 Дж.
| Дано: А= 350 Дж Q1 = 1кДж=103 Дж Т1=500 К | решение:
Термический КПД тепловой машины показывает, какая доля теплоты, полученной от теплоотдачика, превращается в механическую работу. Термический КПД выражается формулой:
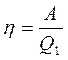 ,
где Q1 - теплота, полученная от теплоотдачика, А – работа, совершенная рабочим телом тепловой машины ,
где Q1 - теплота, полученная от теплоотдачика, А – работа, совершенная рабочим телом тепловой машины
|
| Найти: η-? Т2-? |
Зная КПД цикла, можно из формулы для КПД цикла Карно

найти температуру охладителя Т2:
 .
.
Вычисления:


Ответ: η=35%, Т2=325 К
Задача 3.8. Масса 10 г гелия находится при температуре 300 К. При изобарном нагревании его объем увеличился в 3 раза. Определить изменение внутренней энергии, работу газа и количество теплоты, сообщенное газу.
| Дано: m = 10×10-3 кг М = 4×10-3 кг/моль Т1 = 300 К V2 = 3V1 P = сonst. | Решение:
Изменение внутренней энергии газа можно найти, используя уравнение:
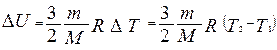 ,
где R=8,31 Дж/(К·моль) – универсальная газовая постоянная; М – молярная масса газа; m – масса газа; Т1 и Т2 – абсолютные температуры начального и конечного состояния газа. ,
где R=8,31 Дж/(К·моль) – универсальная газовая постоянная; М – молярная масса газа; m – масса газа; Т1 и Т2 – абсолютные температуры начального и конечного состояния газа.
|
| Найти: DU =? A =? Q =? |
Для определения температуры T2 воспользуемся законом Гей-Люссака для изобарического процесса

откуда
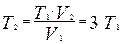
Тогда
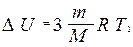 .
.
Работа газа при его расширении определяется выражением:
| А = PDV = P(V2 - V1). |
Воспользовавшись уравнением Менделеева-Клайперона, найдем разность объемов двух состояний газа (V2 – V1):
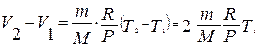 .
.
Тогда
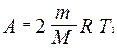 .
.
Для определения количества теплоты, сообщенной газу, воспользуемся первым законом термодинамики для изобарического процесса:
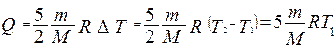
Вычисления:
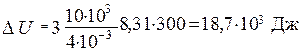
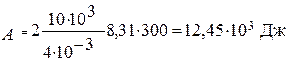
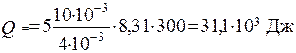
Ответ: DU = 18,7·103 Дж; А = 12,45·103 Дж; Q = 31,1·103 Дж.
Задача 3.9. Газовая смесь состоит из азота массой m1=2 кг и аргона массой m2 = 1 кг. Принимая данные газы за идеальные, определить удельные теплоемкости с V и с P газовой смеси.
| Дано:m1 = 2 кг m2 = 1 кг | Решение:
Количество теплоты, необходимое для нагревания смеси аргона и азота найдем двумя способами:
 (1) (1)
 , (2)
где с V – удельная теплоемкость смеси газов при постоянном объеме; с V1 - удельная теплоемкость азота при постоянном объеме; с V2 - удельная теплоемкость аргона при постоянном объеме. , (2)
где с V – удельная теплоемкость смеси газов при постоянном объеме; с V1 - удельная теплоемкость азота при постоянном объеме; с V2 - удельная теплоемкость аргона при постоянном объеме.
|
| с V -? с P -? |
Приравнивая правые части уравнений (1) и (2) и произведя сокращения, получим

откуда
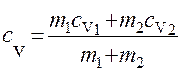 . (3)
. (3)
Аналогично найдем выражение для сР:
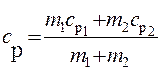 . (4)
. (4)
Удельные теплоемкости идеальных газов при постоянном объеме с V и постоянном давлении с Р выражаются формулами:
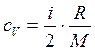 (5)
(5)
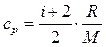
где i – число степеней свободы (для двухатомного газа (азот) i =5, для одноатомного (аргон) i =3); R =8,31  - универсальная газовая постоянная; М1 = 28×10-3 кг/моль – молярная масса азота; М2 = 40×10-3 кг/моль – молярная масса аргона.
- универсальная газовая постоянная; М1 = 28×10-3 кг/моль – молярная масса азота; М2 = 40×10-3 кг/моль – молярная масса аргона.
Подставляя уравнения (5) в формулы (3) и (4), получим
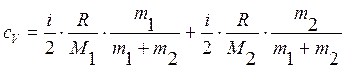
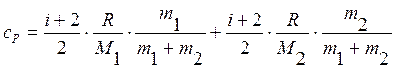 .
.
Вычисления:

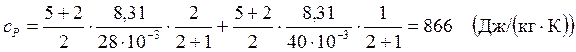
Ответ: 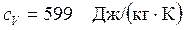 ;
; 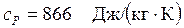
Поиск по сайту: