 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Для найпростіших систем
U = f (V, T). (ІІ.2.47)
Звідси повний диференціал U
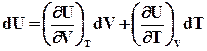 . (ІІ.2.48)
. (ІІ.2.48)
Підставивши значення dU з рівняння (ІІ.2.48) в рівняння (ІІ.2.10) знаходимо:
 (ІІ.2.49)
(ІІ.2.49)
Якщо в системі, що вивчається, має місце лише робота розширення і відсутні інші види роботи, то dW = рdV. Тоді:
 (ІІ.2.50)
(ІІ.2.50)
Позначивши коефіцієнт при диференціалах незалежних змінних у рівнянні (ІІ.2.50) символами l і CV, одержимо
dQ = l dV + CV dT (ІІ.2.51)
Із рівнянь (ІІ.2.48), (ІІ.2.50) і (ІІ.2.51) матимемо:
 (ІІ.2.52)
(ІІ.2.52)
Величини  не є похідними якої-небудь функції. Перша з них є теплотою ізотермічного розширення тіла. Ця величина, розмірність якої співпадає з розмірністю тиску, складається із зовнішнього тиску і величини
не є похідними якої-небудь функції. Перша з них є теплотою ізотермічного розширення тіла. Ця величина, розмірність якої співпадає з розмірністю тиску, складається із зовнішнього тиску і величини  ; останній відображає взаємне притягання молекул і може бути названа внутрішнім тиском. Цей член в рівнянні малий для реальних газів і дуже великий (у порівнянні із звичайними значеннями зовнішнього тиску) для рідин і твердих тіл.
; останній відображає взаємне притягання молекул і може бути названа внутрішнім тиском. Цей член в рівнянні малий для реальних газів і дуже великий (у порівнянні із звичайними значеннями зовнішнього тиску) для рідин і твердих тіл.
Величина CV, у відповідності з рівнянням (ІІ.2.52), є теплоємність при сталому об’ємі. Теплота, що поглинається системою при сталому об’ємі, витрачається повністю на збільшення внутрішньої енергії (при умові, що не виконується ніяка інша робота, в тому числі і робота розширення).
Із рівнянь (ІІ.2.52) і (ІІ.2.48) одержуємо:
dU = (l – р)dV + CV dT (ІІ.2.53)
Коефіцієнти повного диференціала внутрішньої енергії при змінних V і Т мають простий, як це показано вище, фізичний зміст.
Вибравши в ролі незалежних змінних р і Т або V і р і, вважаючи внутрішню енергію функцією цих пар змінних, можна, аналогічно попередньому, одержати:
dQ = h dр + Cp dT, (ІІ.2.54)
dQ = c dV + l dр, (ІІ.2.55)
де величини h, Cp, c, l пов’язані з похідними внутрішньої енергії більш складними співвідношеннями, ніж подані в рівнянні (ІІ.2.52). Слід відмітити, що 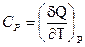 є теплоємністю при сталому тиску, а
є теплоємністю при сталому тиску, а  – теплота ізотермічного зростання тиску.
– теплота ізотермічного зростання тиску.
а) Ізохоричний процес
Якщо об’єм системи в ході процесу залишається сталим, то робота не здійснюється.
Дійсно, якщо DV = 0, то і
W = рDV = 0 (ІІ.2.56)
б) Ізобаричний процес
Припустимо, що система в стані 1 характеризується масою m1, тиском р1, температурою Т1 і об’ємом V1. В стані 2, якщо це закрита система при сталому тиску, змінюється температура й об’єм, які будуть рівні відповідно Т2 і V2. Зміна внутрішньої енергії системи буде визначатись
DU = U2 – U1 = QP – W, (ІІ.2.57)
де QP – величина енергії у формі теплоти при сталому тиску. Робота ідеального газу при його розширенні від об’єму V1 до об’єму V2 згідно з рівнянням (ІІ.2.35) буде рівна
W = р(V2 – V1), (ІІ.2.58)
Значення роботи із рівняння (ІІ.2.58) підставляємо в рівняння (ІІ.2.57) і одержане рівняння записуємо в такій формі
QP= (U2 – U1) + р(V2 – V1) = (U2 + рV2) – (U1 + рV1) (ІІ.2.59)
Функція U + рV, яку ми позначимо через Н, як ми вже зазначали вище, називається ентальпією. Тоді, U2 + рV2 і U1 + рV1 – величини ентальпії відповідно для станів 2 і 1 взятої системи, і рівняння (ІІ.2.59) матиме вигляд:
QP = H2 – H1 = DH (ІІ.2.60)
QP рівна зміні ентальпії. І навпаки – вся енергія у формі тепла, що підводиться, йде на збільшення ентальпії системи.
Поиск по сайту: