 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Строение атома. Уравнение Эйнштейна: E = m×c2
Уравнение Эйнштейна: E = m×c2.
Волновая функция (y) – это функция, определяющая вероятностные характеристики микрочастицы. Вероятность нахождения частицы в бесконечно малом объеме (dV) прямопропорциональна величине y2 (dW ~ y2dV).
Главное квантовое число (n) принимает значения 0, 1, 2, … ∞ и обеспечивает квантование энергии электрона и среднюю удаленность его от ядра.
Граничная поверхность орбитали – поверхность, ограничивающая область пространства с заданной вероятностью нахождения в ней электрона.
Квантовые числа - это целочисленные параметры, входящие в выражение волновой функции и изменяющиеся на единицу. Каждое квантовое число обеспечивает квантование (дискретность) определенной физической величины.
Магнитное орбитальное (азимутальное) квантовое число (ml) принимает значения 0, 1 … ± l и обеспечивает квантование проекции орбитального момента количества движения электрона на одну из осей.
Магнитное спиновое квантовое число (mS) принимает значения от –S до +S и определяет проекцию собственного вращательного момента количества движения микрочастицы на одну из осей; для электрона mS = ±1/2.
Орбитальное квантовое число (l) принимает значения 0, 1 … (n-1) и обеспечивает квантование орбитального момента количества движения электрона, связанного с формой его орбитали.
Правило Клечковского: энергетические подуровни многоэлектронного атома заполняются электронами в порядке возрастания суммы главного и орбитального квантовых чисел; при равных значениях суммы (n + l ) сначала заполняется подуровень с меньшим значением главного квантового числа.
Правило Гунда: при заполнении энергетического подуровня электроны стремятся занять максимальное число орбиталей, ориентируя спин параллельно.
Принцип корпускулярно-волнового дуализма: любому движущемуся материальному объекту можно поставить в соответствие волновой процесс.
Принцип неопределённости: невозможно одновременно с высокой точностью определить положение электрона в пространстве (координаты) и его импульс.
Принцип Паули: для многоэлектронных систем невозможно существование двух электронов с одинаковым набором всех квантовых чисел.
Уравнение Шрёдингера – основное уравнение квантовой механики.
 или
или 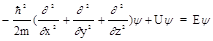 ,
,
где  - оператор полной энергии (оператор Гамильтона, гамильтониан), Е - полная энергия системы.
- оператор полной энергии (оператор Гамильтона, гамильтониан), Е - полная энергия системы.
Спиновое квантовое число (S) обеспечивает квантование собственного вращательного момента количества движения микрочастицы; для электрона S = ½.
Уравнение Планка: E = hn, где h - постоянная Планка (6,625×10-34 Дж×с), n - частота излучения.
Электронная орбиталь – область околоядерного пространства¸ вероятность нахождения электрона в котором существенно отличается от нуля.
Электронная конфигурация – распределение электронов по орбиталям.
Поиск по сайту: