 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Атомные спектры
Всякий спектр представляет собой развертку, разложение излучения на его компоненты. Для получения спектра используется специальный прибор-спектрометр. На рис. 1.8 схематически изображен полный спектр электромагнитного излучения. Обратим внимание на то, что видимый свет составляет только небольшую часть всего спектра электромагнитного излучения. Видимый свет может служить примером непрерывного излучения. В непрерывном излучении содержится излучение со всеми длинами волн в пределах некоторого диапазона. Его спектр называется непрерывным (сплошым) спектром. Примером спектра такого типа является известное всем природное явление-радуга.
Когда пучок непрерывного излучения, например белый свет, пропускают через газообразный образец какого-либо элемента, в прошедшем через образец пучке света недостает излучения с определенными длинами волн. Спектр этого, поглощенного образцом, излучения называется атомным спектром поглощения. Длины волн излучения, поглощенного атомами образца, обнаруживаются по темным линиям на фоне непрерывного спектра.
Если элементы в их газообразном состоянии нагревать до высоких температур или пропускать через них электрический разряд, они испускают излучение с определенными длинами волн. Спектр такого излучения называется атомным спектром испускания или атомным эмиссионным спектром (рис. 1.9).

При изучении излучения ученым удалось установить общие закономерности в характере спектров и найти ряд эмпирических законов, которым они подчиняются. Было установлено, что спектральные линии всех элементов можно разбить на ряд серий.
В 1885 году Бальмеру удалось найти формулу, описывающую распределение спектральных линий видимого спектра водорода:
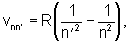

| Спектральные серии водорода | Переход на квантовый уровень n1 | Область спектра |
| Серия Лаймана | ультрафиолетовый | |
| Серия Бальмера | видимый свет | |
| Серия Пашена | инфракрасный | |
| Серия Брэккета | далёкий инфракрасный | |
| Серия Пфунда | --- | |
| Серия Хэмпфри | --- |
Аналогичные серии наблюдаются в спектрах водородоподобных ионов (например, He+, Li2+). С увеличением числа электронов атомные спектры усложняются и закономерности в расположении линий становятся менее выраженными
Поиск по сайту: