 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекция 16. Атом водорода
Для атома водорода и водородоподобных атомов потенциальная энергия:  , где r – расстояние между ядром и электроном. В сферической системе координат уравнение Шредингера:
, где r – расстояние между ядром и электроном. В сферической системе координат уравнение Шредингера:
 , (3.3)
, (3.3)
где  – оператор Лежандра. Ядро считается неподвижным. Чтобы учесть его движение, нужно заменить массу электрона на приведенную массу.
– оператор Лежандра. Ядро считается неподвижным. Чтобы учесть его движение, нужно заменить массу электрона на приведенную массу.
Уравнение (3.3) решается по методу разделения переменных:
 . (3.3а)
. (3.3а)
Из (3.3) следует:
 , (3.4)
, (3.4)
где  – постоянная разделения. Приходим к независимым уравнениям для угловой части Y и радиальной части R волновой функции:
– постоянная разделения. Приходим к независимым уравнениям для угловой части Y и радиальной части R волновой функции:
 , (3.5)
, (3.5)
 . (3.6)
. (3.6)
Решение уравнения (3.5) нам уже известно. Постоянная разделения  , где
, где 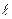 – орбитальное квантовое число. В уравнении (3.6) сумма электростатической и центробежной энергий играет роль эффективной потенциальной энергии (рис.3.1):
– орбитальное квантовое число. В уравнении (3.6) сумма электростатической и центробежной энергий играет роль эффективной потенциальной энергии (рис.3.1):
 . (3.7)
. (3.7)
Потенциальная энергия имеет «яму» с минимальным значением на расстоянии
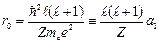 , (3.7a)
, (3.7a)
где 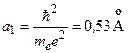 – радиус первой боровской орбиты. Глубина «ямы»:
– радиус первой боровской орбиты. Глубина «ямы»:
 , (3.7б)
, (3.7б)
где  – энергия основного состояния атома водорода.
– энергия основного состояния атома водорода.
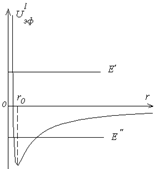 Если энергия частицы положительна (
Если энергия частицы положительна ( ), то ее движение инфинитно. Если энергия отрицательна (
), то ее движение инфинитно. Если энергия отрицательна ( ), то частица находится в потенциальной яме - ее движение финитно. Рассмотрим далее решение уравнения (3.6) при отрицательных значениях энергии. Введем безразмерные переменные:
), то частица находится в потенциальной яме - ее движение финитно. Рассмотрим далее решение уравнения (3.6) при отрицательных значениях энергии. Введем безразмерные переменные:
 . (3.8)
. (3.8)
Решение ищется в виде:
 , (3.9)
, (3.9)
Рис.3.1 Функция  удовлетворяет уравнению:
удовлетворяет уравнению:
 . (3.10)
. (3.10)
Решение ищется в виде бесконечного ряда
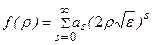 . (3.11)
. (3.11)
Можно получить рекуррентное соотношение
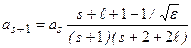 . (3.11а)
. (3.11а)
Ряд (3.11) с коэффициентами (3.11а) расходится быстрее, чем  . В этом случае на больших расстояниях волновая функция (3.9) принимает в пределе бесконечно большие значения. Это противоречит естественному условию убывания волновой функции на бесконечности. Естественное условие будет удовлетворяться, если функцию
. В этом случае на больших расстояниях волновая функция (3.9) принимает в пределе бесконечно большие значения. Это противоречит естественному условию убывания волновой функции на бесконечности. Естественное условие будет удовлетворяться, если функцию  рассматривать в виде полинома некоторой степени
рассматривать в виде полинома некоторой степени  . Ряд (3.11) становится полиномом степени
. Ряд (3.11) становится полиномом степени  при условии
при условии  :
:
 . (3.12)
. (3.12)
Это условие определяет собственные значения энергии водородоподобного атома:
 . (3.12а)
. (3.12а)
 . (3.13)
. (3.13)
Это – в точности формула Бора. Квантование энергии возникает в результате решения уравнения Шредингера как задачи на собственные значения с естественным граничным условием без каких-либо дополнительных постулатов.
Число  - радиальное квантовое число, главное квантовое число:
- радиальное квантовое число, главное квантовое число:
 . (3.13a)
. (3.13a)
При фиксированном числе n орбитальное квантовое число принимает n значений от 0 до n – 1:
 . (3.14)
. (3.14)
Радиальная волновая функция (3.9) зависит от квантовых чисел  . Удобнее пользоваться набором n,
. Удобнее пользоваться набором n, 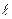 . Стационарные состояния водородоподобного атома описываются волновыми функциями (3.3а):
. Стационарные состояния водородоподобного атома описываются волновыми функциями (3.3а):
 . (3.15)
. (3.15)
Функция 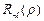 выражается через обобщенные полиномы Лягерра:
выражается через обобщенные полиномы Лягерра:
 . (3.15а)
. (3.15а)

 . При m= 0 полиномы
. При m= 0 полиномы 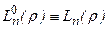 - полиномы Лягерра.
- полиномы Лягерра.
Состояние водородоподобного атома характеризуется набором чисел  . Однако значение энергии каждого состояния (3.13) определяется только главным квантовым числом. Ситуация, при которой различным волновым функциям отвечает одно и то же значение энергии, характерна для вырожденных состояний. Для водородоподобного атома каждое значение энергии вырождено не только по магнитному квантовому числу (как в случае ротатора), но и по орбитальному квантовому числу. Подсчитаем кратность вырождения уровней энергии водородоподобного атома. Кратность вырождения уровней - это количество различных волновых функций, отвечающих
. Однако значение энергии каждого состояния (3.13) определяется только главным квантовым числом. Ситуация, при которой различным волновым функциям отвечает одно и то же значение энергии, характерна для вырожденных состояний. Для водородоподобного атома каждое значение энергии вырождено не только по магнитному квантовому числу (как в случае ротатора), но и по орбитальному квантовому числу. Подсчитаем кратность вырождения уровней энергии водородоподобного атома. Кратность вырождения уровней - это количество различных волновых функций, отвечающих
Рис.3.2 одному и тому же значению энергии. Для водородоподобного
атома кратность вырождения определяется суммой:
 . (3.16)
. (3.16)
Каждый уровень энергии водородоподобного атома является  – кратно вырожденным.
– кратно вырожденным.
Состояния электрона в атоме обозначают с помощью буквы, которая соответствует численному значению орбитального квантового числа, а также с помощью цифры, стоящей перед этой буквой и соответствующей значению главного квантового числа: 1 s; 2 s, 2 p; 3 s, 3 p, 3 d; 4 s, 4 p, 4 d, 4 f;... Диаграмма уровней энергии атома водорода (рис.3.2) - диаграмма Гротриана (1928).
Состояние 1 s –основное состояние. Остальные состояния возбужденные. Некоторые волновые функции для водородоподобного атома:
n = 1 – состояние 1 s:
 (3.17)
(3.17)
n = 2 – состояние 2 s:
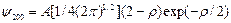
состояние 2 p:

 (3.17а)
(3.17а)
n = 3 – состояние 3 s:

состояние 3 p:
 (3.17б)
(3.17б)
состояние 3 d:
 (3.17в)
(3.17в)
Постоянная  .
.
Переходы между различными состояниями возможны при выполнении правил отбора:  На изменение главного квантового числа n нет каких-либо ограничений.
На изменение главного квантового числа n нет каких-либо ограничений.
Квадрат модуля волновой функции (3.15) - плотность вероятности того, что электрон находится в элементе объема  , где
, где 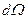 – элемент телесного угла:
– элемент телесного угла:
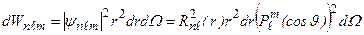 . (3.18)
. (3.18)
Распределения по углам и по радиусу - независимы. Вероятность углового распределения совпадает с вероятностью состояний ротатора. Распределение электронного заряда по радиусу:
 . (3.19)
. (3.19)
Условие нормировки  . Величина
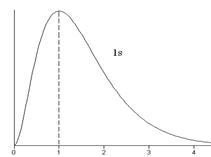
. Величина 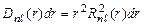 - вероятность того, что электрон находится на расстоянии от r до r + dr от ядра атома. Графики функции
- вероятность того, что электрон находится на расстоянии от r до r + dr от ядра атома. Графики функции  для некоторых состояний изображены на рис.3.3.
для некоторых состояний изображены на рис.3.3.
Функция 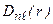 в состояниях с максимальным значением орбитального квантового числа
в состояниях с максимальным значением орбитального квантового числа  . Число
. Число  . Из (3.11):
. Из (3.11):  . Так что
. Так что  . Плотность вероятностей в этих состояниях:
. Плотность вероятностей в этих состояниях:  . Это «одногорбая» функция, имеет максимум при
. Это «одногорбая» функция, имеет максимум при  , т.е. на расстояниях
, т.е. на расстояниях  – радиусов боровских орбит. В состояниях 1 s, 2 p, 3 d, 4 f,... наиболее вероятно найти электрон на расстояниях, равных боровским радиусам. Квантовая механика приводит к «размазанному» соответствию с теорией Бора. С возрастанием числа n ширина кривой
– радиусов боровских орбит. В состояниях 1 s, 2 p, 3 d, 4 f,... наиболее вероятно найти электрон на расстояниях, равных боровским радиусам. Квантовая механика приводит к «размазанному» соответствию с теорией Бора. С возрастанием числа n ширина кривой  вблизи
вблизи  становится более узкой, при
становится более узкой, при 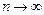 функция
функция  стремится к дельта–функции
стремится к дельта–функции  . В этом проявляется принцип соответствия. Для получения полной картины распределения электронной плотности в
. В этом проявляется принцип соответствия. Для получения полной картины распределения электронной плотности в
 |  | ||
пространстве необходимо учесть угловую зависимость по формуле (3.18).
 |  |  | |||
Рис.3.3
На рис.3.3а изображено вероятное распределение электронного облака в различных соcтояниях атома водорода. В состояниях с максимальным значением магнитного квантового числа (2 p (m= 1), 3 d (m= 2), 4 f (m= 3),…) электронный заряд концентрируется вблизи плоскости х, у.

Рис.3.3а
Волновые функции (3.17)–(3.17в) описывают состояния с центрально–симметричным распределением заряда вокруг ядра, так что в этих состояниях электрический дипольный момент отсутствует. Из-за вырождения уровней энергии в атоме водорода существуют состояния с несимметричным распределением электронного заряда относительно плоскости z = 0. Например, суперпозиция волновых функций  и
и 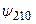 , отвечающих уровню энергии с n = 2:
, отвечающих уровню энергии с n = 2:
 .
.
Эта волновая функция имеет узловую поверхность  - параболоид вращения с осью z и фокус в начале координат. Распределение электронной плотности несимметрично относительно плоскости
- параболоид вращения с осью z и фокус в начале координат. Распределение электронной плотности несимметрично относительно плоскости  : среднее положение электрона вдоль оси z отлично от нуля:
: среднее положение электрона вдоль оси z отлично от нуля:  . В этом состоянии атом водорода обладает электрическим дипольным моментом.
. В этом состоянии атом водорода обладает электрическим дипольным моментом.
Поиск по сайту: