 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Оксиды. Гидроксиды. Соли
|
Читайте также: |
Оксид натрия. 1. Взаимодействие металлического натрия с кислородом:

Чистый оксид натрия получить непосредственным окислением натрия нельзя, так как образуется смесь, состоящая из 20 % оксида натрия и 80 % пероксида натрия:

2. Взаимодействие металлического натрия с нитратом натрия:

3. Прокаливание пероксида натрия с избытком натрия:

4. Прокаливанием карбоната натрия при 1000 °C, получаемого в свою очередь прокаливанием гидрокарбоната натрия при 200 °C.
Гидроксиды натрия. Гидрат окиси натрия NaOH — белое твёрдое вещество. Если оставить кусок едкого натра на воздухе, то он вскоре расплывается, так как притягивает влагу из воздуха. Едкий натр хорошо растворяется в воде, при этом выделяется большое количество теплоты. Раствор едкого натра мылок на ощупь.Гидроксид натрия вступает в реакции: нейтрализации с различными веществами в любых агрегатных состояниях, от растворов и газов до твёрдых веществ, с неметаллами, с металлами, с эфирами, амидами и алкилгалогенидами (гидролиз).
Соли натрия. Натрия соли — натрий образует соли со всеми кислотами. Амид натрия NaNH2 — восстановитель. Арсенат натрия Na3AsO4, арсенит натрия NaAsO2 (Na3AsO3) — ядохимикаты. Бромид натрия NaBr применяют в медицине и фотографии. Бихромат натрия Na2Cr2O7 — окислитель, дубильное вещество. Карбонат натрия Na2CO3 и бикарбонат натрия NaHCO3. Нитрат натрия NaNO3 — азотное удобрение. Нитрит натрия NaNO2 — в синтезе органических веществ (напр., азокрасителей), в медицине. Силикат натрия Na2SiO3 — растворимое стекло. Сульфат натрия Na2SO4 — в стекольной, целлюлозно-бумажной, кожевенной, текстильной, мыловаренной промышленности. Сульфид натрия Na2S — для получения сернистых красителей, в текстильной и кожевенной промышленности, используют при флотации руд, в аналитической химии для разделения элементов; гидросульфид натрия NaHS — в производстве искусственного шелка, в кожевенной промышленности; полисульфиды натрия Na2Sn — при флотации руд, в сельском хозяйстве. Сульфит натрия Na2SO3 — в фотографии, медицине, в производстве искусственного волокна, гидросульфит NaHSO3 — как консервирующее средство, при белении и крашении тканей. Тиосульфат натрия Na2S2O3 — в фотографии, медицине, аналитической химии. Фосфаты натрия — моющие и водоумягчающие средства, для обогащения руд, в пищевой промышленности и др. Фторид натрия NaF — для консервирования древесины, в сельском хозяйстве, в производстве эмалей и флюсов. Хлорид натрия (поваренная соль) NaCl — в производстве соды, едкого натра, хлора, сульфата натрия, в технике, в медицине, в сельском хозяйстве, вкусовое и консервирующее средство.
Калий и его оксиды. Химически активное вещество. На воздухе расплывается, поглощает СО2, давая К2СО3:

Бурно реагирует с водой, образуя KOH:

Реагирует со спиртом, с эфиром. Энергично взаимодействует с галогенами, расплавленной серой, разбавленными кислотами, образуя различные соединения калия.
- Гидроксиды. Взаимодействие с кислотами с образованием соли и воды ( реакция нейтрализации):
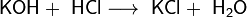

- Взаимодействие с кислотными оксидами с образованием соли и воды:


- Взаимодействие с переходными металлами в растворе с образованием комплексной соли и водорода:

Также гидроксид калия получают электролизом растворов KCl, обычно с применением ртутных катодов, что дает продукт высокой чистоты, не содержащий примеси хлоридов.
Соли. Хлорид калия — химическое соединение KCl, калиевая соль соляной кислоты.
Белое кристаллическое вещество без запаха. Относится к структурному типу NaCl. В природе встречается в виде минералов сильвина и карналлита, а также входит в состав сильвинита.
В лабораторных условиях хлорид калия можно получить взаимодействием гидроксида калия с соляной кислотой:
KOH + HCl → KCl + H2O
В жизни человека, кроме жиров, белков, углеводов, витаминов, огромную роль играют химические элементы. В организме человека и животного можно найти значительную часть элементов периодической таблицы Д.И. Менделеева. Так, в настоящее время обнаружено свыше 70 химических элементов, содержащихся в тканях организма в различных количествах (макро- и микроэлементы). В молоке млекопитающих обнаружено 23 микроэлемента: литий, рубидий, медь, серебро, барий, стронций, титан, мышьяк, ванадий, хром, молибден, иод, фтор, марганец, железо, кобальт, никель и др.
В состав крови млекопитающих входит 24 микроэлемента, а в состав головного мозга человека — 18 микроэлементов.
Как можно заметить, в клетке нет каких-либо особенных элементов, характерных только для живой природы, т. е. на атомном уровне различий между живой и неживой природой нет. Эти различия обнаруживаются лишь на уровне сложных веществ — на молекулярном уровне. Так, наряду с неорганическими веществами (водой и минеральными солями) клетки живых организмов содержат вещества, характерные только для них, — органические вещества (белки, жиры, углеводы, нуклеиновые кислоты, витамины, гормоны и др.). Эти вещества построены в основном из углерода, водорода, кислорода и азота, т. е. из макроэлементов. Микроэлементы содержатся в этих веществах в незначительных количествах, тем не менее их роль в нормальной жизнедеятельности организмов огромна. Например, соединения бора, марганца, цинка, кобальта резко увеличивают урожайность отдельных сельскохозяйственных растений и повышают их сопротивляемость к различного рода заболеваниям.
Человек и животные получают нужные им для нормальной жизнедеятельности микроэлементы через растения, которыми питаются. Если в пище не хватает марганца, то возможна задержка роста, замедление наступления половой зрелости, нарушение обмена веществ при формировании скелета. Добавка долей миллиграмма солей марганца к суточному рациону животных устраняет эти заболевания.
Кобальт входит в состав витамина В12, отвечающего за работу кроветворных органов. Недостаток кобальта в пище часто вызывает серьезное заболевание, которое приводит к истощению организма и даже к гибели.
Значение микроэлементов для человека впервые было выявлено при изучении такого заболевания, как эндемический зоб, которое вызывалось недостатком иода в пище и воде. Прием соли, содержащей иод, приводит к выздоровлению, а добавка его к пище в малых количествах предупреждает заболевание. С этой целью проводят иодирование пищевой поваренной соли, в которую добавляют 0,001—0,01% иодида калия.
В состав большинства биологических катализаторов-ферментов входят цинк, молибден и некоторые другие металлы. Эти элементы, содержащиеся в клетках живых организмов в очень малых количествах, обеспечивают нормальную работу тончайших биохимических механизмов, являются подлинными регуляторами процессов жизнедеятельности.
Многие микроэлементы содержатся в витаминах — органических веществах различной химической природы, поступающих в организм с пищей в малых дозах и оказывающих большое влияние на обмен веществ и общую жизнедеятельность организма. По своему биологическому действию они близки к ферментам, но ферменты образуются клетками организма, а витамины обычно поступают с пищей. Источниками витаминов служат растения: цитрусовые, шиповник, петрушка, лук, чеснок и многие другие. Некоторые витамины — А, В1, В2, К — получают синтетическим путем. Свое название витамины получили от двух слов: вита — жизнь и амин — содержащий азот.
Элементы группы II А
Магний. Кальций.
Магний, химический элемент II группы периодической системы. Название от новолат. magnesia — магнезия. Серебристый металл, очень лёгкий и прочный; плотность 1,74 г/см3, t пл 650°C. На воздухе покрывается защитной оксидной плёнкой; подожжённая тонкая стружка и порошок магния горят ярким белым пламенем. По распространённости в земной коре занимает среди элементов 8-е место (минералы магнезит, доломит, карналлит). Применяется главным образом в производстве лёгких сплавов, для раскисления и обессеривания некоторых металлов, для восстановления Hf, Ti, U, Zr и других металлов из соединений (металлотермия).
Оксиды магния. Оксид магния (жжёная магнезия, периклаз) — химическое соединение с формулой MgO, белые кристаллы, нерастворимые в воде, взрывобезопасен.
Оксид магния получают обжигом минералов магнезита и доломита.
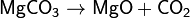
Гидроксид магния. Неорганический гидроксид щелочноземельного металла магния. Относится к классу нерастворимых оснований. При стандартных условиях гидроксид магния представляет собой бесцветные кристаллы с гексагональной решёткой. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде, но растворим в солях аммония. Является основанием средней силы. Встречается в природе в виде минерала брусита.
Соли магния. Карбонат магния, магний углекислый, MgCO3 — магниевая соль угольной кислоты. Бесцветные кристаллы, плотность 3,037 г/см³. При 500 °C заметно, а при 650 °C полностью разлагается на MgO и CO2. Растворимость карбоната магния в воде незначительна (22 мг/л при 25 °C) и уменьшается с повышением температуры. При насыщении CO2 водной суспензии MgCO3 последний растворяется вследствие образования гидрокарбоната Мg(HCO3)2. Из водных растворов в отсутствие избытка CO2 выделяются основные карбонаты магния. С карбонатами ряда металлов карбонат магния образует двойные соли, к которым относится и природный минерал доломит MgCO3·CaCO3.
Кальций, химический элемент, относится к семейству щелочноземельных металлов Be, Mg, Ca, Sr, Ba, Ra, составляющих IIA подгруппу периодической системы элементов. Открыт Х.Дэви в 1808. Кальций - третий после алюминия и железа из наиболее распространенных металлов в земной коре, его получают преимущественно из известняка (карбонат кальция). Ведущими производителями кальция являются Австрия, Бразилия, Канада, Финляндия, Израиль и Норвегия.
Оксиды кальция. Оксид кальция (окись кальция, негашёная и́звесть или «кипелка», «кираби́т») — белое кристаллическое вещество, формула CaO.Негашёная известь и продукт её взаимодействия с водой — Ca(OH)2 (гашёная известь или «пушонка») находят обширное использование в строительном деле.
В промышленности оксид кальция получают термическим разложением известняка (карбоната кальция):

Также оксид кальция можно получить при взаимодействии простых веществ:

или при термическом разложении гидроксида кальция и кальциевых солей некоторых кислородсодержащих кислот:

Гидроксиды кальция. Представляет собой порошок белого цвета, плохо растворимый в воде. Получают путём взаимодействия оксида кальция (негашёной извести) с водой (процесс получил название «гашение извести»):
CaO + H2O → Ca(OH)2
Эта реакция экзотермическая, идёт с выделением 16 ккал (67 кДж) на моль.
Соли кальция. Как хлорид CaCl2, бромид CaBr2, иодид CaI2 и нитрат Ca(NO3)2, хорошо растворимы в воде. Нерастворимы в воде фторид CaF2, карбонат CaCO3, сульфат CaSO4, ортофосфат Ca3(PO4)2, оксалат СаС2О4 и некоторые другие.
Растворимость — способность вещества образовывать с другими веществами однородные системы — растворы, в которых вещество находится в виде отдельных атомов, ионов, молекул или частиц. Растворимость выражается концентрацией растворённого вещества в его насыщенном растворе либо в процентах, либо в весовых или объёмных единицах, отнесённых к 100 г или 100 см³ (мл) растворителя (г/100 г или см³/100 см³). Растворимость газов в жидкости зависит от температуры и давления. Растворимость жидких и твёрдых веществ — практически только от температуры.
Ион Mg2+ - более сильный комплексообразователь, чем ион Са2+, и поэтому служит центром некоторых металлоферментов, например, катализирует столь важный гидролиз АТФ. В растительном мире Mg2+ входит в координационный центр хлорофилла, управляющего таким глобальным процессом, как фотосинтез, состоящий в превращении Н2О и СО2 в углеводы и О2 под действием световой энергии. В этой окислительно-восстановительной реакции СО2 восстанавливается до углеводов, а Н2О окисляется до О2. На 1-й стадии фотосинтеза хлорофилл, в координационном центре которого находится ион Mg(2+), фотохимически возбуждается и с участием железосерных белков восстанавливает СО2. 2-я стадия фотосинтеза включает целую серию реакций с участием молекул АДФ, АТФ, производных хинона, комплексов Mn(2+) и Mn(4+), в результате чего Н2О окисляется до О2. Надо отметить, что координация Mg2+ с хлорофиллом нетипична с точки зрения классических представлений о Mg как комплексообразователе, так как он координирован с донорными атомами N и проявляет нехарактерное для него координационное число 5.Содержание Са2+ в организме составляет ~1%, он содержится в каждой клетке живого организма. Кальций – 5-й по распространённости in vivo элемент после C, H, O, N. В организмах млекопитающих 95% кальция приходится на твердые ткани: кости и зубы, где он находится в виде фторапатита и гидроксиапатита; в организмах птиц и моллюсков преобладает СаСО3. Кальций тесно связан с процессами биоминерализации. В стенках сосудов и артерий кальций присутствует в виде СаСО3, комплекса с холестерином, а в почках – в виде оксалатов или уратов (солей мочевой кислоты). Ионы Са2+ принимают активное участие в сокращении мышечных волокон, активации многих ферментов (табл.1), регуляции процесса свертывания крови. Концентрация Са2+ в организме регулируется гормонами паращитовидных желез кальцитонином, а усвоение определяется содержанием в организме витамина D. Недостаток этого витамина приводит к снижению всасывания Са и проявляется в виде заболевания рахита. Са – внеклеточный элемент; его концентрация в клетке мала: ~ 10 –7 моль/л, а вне клетки - ~ 10-3 моль/л, причем этот градиент концентраций сохраняется благодаря Са-насосу. Некоторые соли Са2+ применяются в качестве лекарственных средств: хлорид и глюконат, гипс CaSO4.
Хлорофилл. Зелёный пигмент растений, с помощью которого они улавливают энергию солнечного света и осуществляют фотосинтез. Локализован в особых клеточных структурах — хлоропластах или хроматофорах и связан с белками и липидами мембран. Основу структуры молекулы Х, составляет магниевый комплекс порфиринового цикла; в IV пиррольном кольце к остатку пропионовой кислоты присоединён высокомолекулярный спирт фитол, который придаёт Х. способность встраиваться в липидный слой мембран хлоропластов.
Растворимые соли кальция и магния обуславливают общую жёсткость воды. Если они присутствуют в воде в небольших количествах, то вода называется мягкой. При большом содержании этих солей (100 – 200 мг. солей кальция – в 1 л. в пересчёте на ионы) вода считается жёсткой. В такой воде мыло плохо пенится, так как соли кальция и магния образуют с ним нерастворимые соединения. В жёсткой воде плохо развариваются пищевые продукты, и при кипячении она даёт на стенках паровых котлов накипь. Накипь плохо проводит теплоту, вызывает увеличение расхода топлива и ускоряет изнашивание стенок котла. Образование накипи – сложный процесс. При нагревании кислые соли угольной кислоты кальция и магния разлагаются и переходят в нерастворимые карбонаты:
Са + 2НСО3 = Н2О + СО2 + СаСО3↓
Растворимость сульфата кальция СаSO4 при нагревании также снижается, поэтому он входит в состав накипи. Жёсткость вызванная присутствием в воде гидрокарбонатов кальция и магния, называется карбонатной или временной, так как она устраняется при кипячении. Помимо карбонатной жёсткости, различают ещё некарбонатную жёсткость, которая зависит от содержания в воде сульфатов и хлоридов кальция и магния. Эти соли не удаляются при кипячении, и поэтому некарбонатную жёсткость называют также постоянной жёсткостью. Карбонатная и некарбонатная жёсткость в сумме даёт общую жёсткость.
Для полного устранения жёсткости воду иногда перегоняют. Для устранения карбонатной жёсткости воду кипятят. Общую жёсткость устраняют или добавлением химических веществ, или при помощи так называемых катионитов. При использовании химического метода растворимые соли кальция и магния переводят в нерастворимые карбонаты, например добавляют известковое молоко и соду:
Са + 2НСО3 + Са + 2ОН = 2Н2О + 2СаСО3↓
Са + SO4 + 2Na + CO3 = 2Na + SO4 + CaCO3↓
Устранение жёсткости при помощи катионитов – процесс более совершенный. Катиониты – сложные вещества (природные соединения кремния и алюминия, высокомалекулярные органические соединения), состав которых можно выразить формулой Na2R, где R – сложный кислотный остаток. При фильтровании воды через слой катионита происходит обмен ионов (катионов) Na на ионы Са и Mg.
Следовательно, ионы Са из раствора переходят в катионит, а ионы Na переходят из катионита в раствор. Для восстановления использованного катионита его промывают раствором поваренной соли. При этом происходит обратный процесс: ионы Са в катионите заменяются на ионы Na:
2Na + 2Cl + CaR = Na2R + Ca + 2Cl
Регенерированный катионит можно снова применять для очистки воды.
8. В виде чистого металла Са применяют как восстановитель U, Th, Cr, V, Zr, Cs, Rb и некоторых редкоземельных металлов и их соединений. Его используют также для раскисления сталей, бронз и других сплавов, для удаления серы из нефтепродуктов, для обезвоживания органических жидкостей, для очистки аргона от примесей азота и в качества поглотителя газов в электровакуумных приборах.
Биологическая роль кальция и магния
Вследствие очень легкой окисляемости щелочные металлы встречаются в природе исключительно в виде соединений. В медицинской практике используются следующие соединения магния и кальция.
Оксид магния МgO (жженая магнезия), основной карбонат магния Мg(ОН)2 • 4МgСО3 • Н2О (белая магнезия), кальция карбонат СаСО3 (мел осажденный) являются основными антацидными средствами, применяемыми для уменьшения кислотности желудочного сока.
Магния сульфат МgSO4 • 7Н2O (горькая соль или магнезия) используется при гипертонии как слабительное и желчегонное средство, а также как успокаивающее средство для ЦНС.
Кальций хлористый СаCl2 • 6Н2О применяют как противовоспалительное и антиаллергическое средство, для снятия сердечно-сосудистого спазма, для улучшения свертывания крови, при переломах костей и ревматизме.
Органические соединения кальция: глютаминат, глюконат, глицерофосфат, аденозинтрифосфат, пантотенат и пангамат Са применяются как общеукрепляющие средства.
Гипс 2СаSO4• Н2О широко используется в травматологической и стоматологической практике, так как при замешивании его с водой образуется нерастворимый СаSО4 • 2Н2O.
В результате происходит быстрое затвердение с некоторым увеличением объема, что используется для фиксации при переломах костей и получения хороших слепков в стоматологии.
Поиск по сайту: