 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Элементы группы V A
Подгруппу азота составляют пять элементов: азот, фосфор, мышьяк, сурьма и висмут. Это р-элементы V группы периодической системы Д. И. Менделеева. Поэтому высшая степень окисления этих элементов +5, низшая -3, характерна и +3.
Наличие трех неспаренных электронов на наружном уровне говорит о том, что в невозбужденном состоянии атомы элементов имеют валентность 3. Наружный уровень атома азота состоит только из двух подуровней — 2s и 2р. У атомов же остальных элементов этой подгруппы на наружных энергетических уровнях имеются вакантные ячейки d-подуровня. Следовательно, один из s-электронов наружного уровня может при возбуждении перейти на d-подуровень того же уровня, что приводит к образованию 5 неспаренных электронов.
Азот. Химический элемент V группы периодической системы Менделеева, атомный номер 7, атомная масса 14,0067; бесцветный газ, не имеющий запаха и вкуса. Азот входит в состав всех живых организмов. В небольших кол-вах содержится в каменном угле (1,0-2,5%) и нефти (0,2-1,7%). Велико значение азота в жизнедеятельности растений и животных: в белках его до 17%, в организме человека в целом около 3%. Среди органогенных элементов азот играет одну из важных ролей в жизни растений, несмотря на то, что в сухой массе растительных тканей его содержится всего 1–3%. Невысокая урожайность многих сельскохозяйственных культур чаще всего определяется недостатком именно азота. Для формирования урожая зерновых культур 2–3 т с одного гектара необходимо 150–200 кг азота в доступной для растений минеральной форме при общем содержании его в почве от 5 до 15 т на 1 га. При недостатке азота в среде обитания тормозится рост растений, ослабляется образование боковых побегов и кущение у злаков, наблюдается мелколистность. Одно из ранних проявлений азотного дефицита – бледно-зеленая окраска листьев, вызванная ослаблением синтеза хлорофилла. Длительное азотное голодание ведет к гидролизу белков и разрушению хлорофилла прежде всего в нижних, более старых листьях и оттоку растворимых соединений азота к более молодым листьям. Вследствие разрушения хлорофилла окраска нижних листьев в зависимости от вида растения приобретает желтые, оранжевые или красные тона, а при сильно выраженном азотном дефиците возможно появление некрозов (омертвление).
С водородом азот образует два соединения: аммиак NH3 и гидразин N2H4 (H2N – NH2). Наибольшее значение имеет аммиак.
В лаборатории получают слабым нагреванием смеси хлорида аммония с гидроксидом натрия:
NH4Cl + NaOH = NaCl + NH3 + H2O
Основным промышленным способом получения аммиака является синтез его из азота и водорода
N2 + 3H2 ↔ 2NH3 ∆ Н0 = - 82,4
(Катализатор Pt; t = 450 - 5000С; Р = 250 атм)
Равновесие обратимой реакции смещается вправо действием высокого давления ≈ 30МПа.
NH3 – бесцветный газ с резким характерным запахом, почти в 2 раза легче воздуха. Молекула NH3 поляризована – общие электронные пары сдвинуты к азоту. Кроме того, у атома азота остается неподеленной пара электронов. Это дополнительно увеличивает полярность и обуславливает многие свойства аммиака. Жидкий аммиак, подобно воде, хороший растворитель ионных соединений. Молекулы в жидком аммиаке ассоциированы за счет образования водородных связей.
Аммиак. Аммиак — NH3, нитрид водорода, при нормальных условиях — бесцветный газ с резким характерным запахом (запах нашатырного спирта)
Аммиак почти вдвое легче воздуха, ПДКр.з. 20 мг/м3 — IV класс опасности (малоопасные вещества) по ГОСТ 12.1.007. Растворимость NH3 в воде чрезвычайно велика — около 1200 объёмов (при 0 °C) или 700 объёмов (при 20 °C) в объёме воды. В холодильной технике носит название R717, где R — Refrigerant (хладагент), 7 — тип хладагента (неорганическое соединение), 17 — молекулярная масса.
Молекула аммиака имеет форму тригональной пирамиды с атомом азота в вершине. Три неспаренных p-электрона атома азота участвуют в образовании полярных ковалентных связей с 1s-электронами трёх атомов водорода (связи N−H), четвёртая пара внешних электронов является неподелённой, она может образовать донорно-акцепторную связь с ионом водорода, образуя ион аммония NH4+. Благодаря тому, что не связывающее двухэлектронное облако строго ориентировано в пространстве, молекула аммиака обладает высокой полярностью, что приводит к его хорошей растворимости в воде.
В жидком аммиаке молекулы связаны между собой водородными связями. Сравнение физических свойств жидкого аммиака с водой показывает, что аммиак имеет более низкие температуры кипения (tкип −33,35 °C) и плавления (tпл −77,70 °C), а также более низкую плотность, вязкость (вязкость жидкого аммиака в 7 раз меньше вязкости воды), проводимость и диэлектрическую проницаемость. Это в некоторой степени объясняется тем, что прочность этих связей в жидком аммиаке существенно ниже, чем у воды, а также тем, что в молекуле аммиака имеется лишь одна пара неподелённых электронов, в отличие от двух пар в молекуле воды, что не дает возможность образовывать разветвлённую сеть водородных связей между несколькими молекулами. Аммиак легко переходит в бесцветную жидкость с плотностью 681,4 кг/м³, сильно преломляющую свет. Подобно воде, жидкий аммиак сильно ассоциирован, главным образом за счёт образования водородных связей. Жидкий аммиак практически не проводит электрический ток. Жидкий аммиак — хороший растворитель для очень большого числа органических, а также для многих неорганических соединений. Твёрдый аммиак — бесцветные кубические кристаллы.
Благодаря наличию неподеленной электронной пары во многих реакциях аммиак выступает как основание Бренстеда или комплексообразователь (не следует путать понятия «нуклеофил» и «основание Бренстеда». Нуклеофильность определяется сродством к положительно заряженной частице. Основание имеет сродство к протону. Понятие «основание» является частным случаем понятия «нуклеофил»). Так, он присоединяет протон, образуя ион аммония:

Водный раствор аммиака («нашатырный спирт») имеет слабощелочную реакцию из-за протекания процесса:

Взаимодействуя с кислотами даёт соответствующие соли аммония:

Аммиак также является очень слабой кислотой (в 10 000 000 000 раз более слабой, чем вода), способен образовывать с металлами соли — амиды. Соединения, содержащие ионы NH2−, называются амидами, NH2− — имидами, а N3− — нитридами. Амиды щелочных металлов получают, действуя на них аммиаком:

Фенолфталеин в этих растворах окрашивается в малиновый цвет, при добавлении кислот происходит их нейтрализация. Растворимость амидов изменяется в такой же последовательности, что и растворимость гидроксидов: LiNH2 — нерастворим, NaNH2 — малорастворим, KNH2, RbNH2 и CsNH2 — хорошо растворимы.
С кислородом азот образует ряд оксидов: N2О и NО - бесцветные газы, N2О3 голубое твердое вещество (ниже -100 град.С), NО2 - бурый газ, N2О4 - бесцветный газ, N2О5 - бесцветные кристаллы.
Оксид N2О (закись азота, "веселящий газ", поскольку он обладает наркотическим действием) получают термическим разложением нитрата аммония или гидроксиламмония:
[НN3ОН]NО2 = N2О + 2Н2О (внутримолекулярное конпропорционирование)
Оксид азота (+1) - эндотермическое соединение. Однако при комнатной химически температуре мало активен. При нагревании его реакционная способность сильно возрастает. Он окисляет водород, металлы, фосфор, серу, уголь, органические и другие вещества, например:
Сu + N2О = N2 + СuО
При нагревании N2О выше 700 град.С одновременно с реакцией разложения протекает его диспропорционирование:
2N2О = 2N2 + О2; 2N2О = 2NО + N2
Азотистая кислота HNO2 — слабая одноосновная кислота, существует только в разбавленных водных растворах, окрашенных в слабый голубой цвет, и в газовой фазе. Соли азотистой кислоты называются нитритами или азотистокислыми. Нитриты гораздо более устойчивы, чем HNO2, все они токсичны.
В водных растворах существует равновесие:

При нагревании раствора азотистая кислота распадается с выделением NO и образованием азотной кислоты:

HNO2 является слабой кислотой. В водных растворах диссоциирует (KD=4,6·10−4), немного сильнее уксусной кислоты. Легко вытесняется более сильными кислотами из солей:
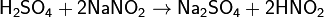
Азотистая кислота проявляет как окислительные, так и восстановительные свойства. При действии более сильных окислителей (пероксид водорода, хлор, перманганат калия) окисляется в азотную кислоту:



В то же время она способна окислять вещества, обладающие восстановительными свойствами:
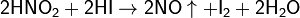
Азотная кислота является сильной кислотой. Её соли — нитраты — получают действием HNO3 на металлы, оксиды, гидроксиды или карбонаты. Все нитраты хорошо растворимы в воде. Нитрат-ион в воде не гидролизуется.
Соли азотной кислоты при нагревании необратимо разлагаются, причём состав продуктов разложения определяется катионом:
а) нитраты металлов, стоящих в ряду напряжений левее магния:

б) нитраты металлов, расположенных в ряду напряжений между магнием и медью:

в) нитраты металлов, расположенных в ряду напряжений правее ртути:

г) нитрат аммония:

Нитраты в водных растворах практически не проявляют окислительных свойств, но при высокой температуре в твердом состоянии являются сильными окислителями, например, при сплавлении твердых веществ:

Цинк и алюминий в щелочном растворе восстанавливают нитраты до NH3:

Соли азотной кислоты — нитраты — широко используются как удобрения. При этом практически все нитраты хорошо растворимы в воде, поэтому в виде минералов их в природе чрезвычайно мало; исключение составляют чилийская (натриевая) селитра и индийская селитра (нитрат калия). Большинство нитратов получают искусственно. С азотной кислотой не реагируют стекло, фторопласт-4.
Биологическая роль азота. Фиксация атмосферного азота в природе происходит по двум основным направлениям — абиогенному и биогенному. Первый путь включает главным образом реакции азота с кислородом. Так как азот химически весьма инертен, для окисления требуются большие количества энергии (высокие температуры). Эти условия достигаются при разрядах молний, когда температура достигает 25000 °C и более. При этом происходит образование различных оксидов азота. Существует также вероятность, что абиотическая фиксация происходит в результате фотокаталитических реакций на поверхности полупроводников или широкополосных диэлектриков (песок пустынь).
Однако основная часть молекулярного азота (около 1,4·108 т/год) фиксируется биотическим путём. Долгое время считалось, что связывать молекулярный азот могут только небольшое количество видов микроорганизмов (хотя и широко распространённых на поверхности Земли): бактерии Azotobacter и Clostridium, клубеньковые бактерии бобовых растений Rhizobium, цианобактерии Anabaena, Nostoc и др. Сейчас известно, что этой способностью обладают многие другие организмы в воде и почве, например, актиномицеты в клубнях ольхи и других деревьев (всего 160 видов). Все они превращают молекулярный азот в соединения аммония (NH4+). Этот процесс требует значительных затрат энергии (для фиксации 1 г атмосферного азота бактерии в клубеньках бобовых расходуют порядка 167,5 кДж, то есть окисляют примерно 10 г глюкозы). Таким образом, видна взаимная польза от симбиоза растений и азотфиксирующих бактерий — первые предоставляют вторым «место для проживания» и снабжают полученным в результате фотосинтеза «топливом» — глюкозой, вторые обеспечивают необходимый растениям азот в усваиваемой ими форме.
Азот в форме аммиака и соединений аммония, получающийся в процессах биогенной азотфиксации, быстро окисляется до нитратов и нитритов (этот процесс носит название нитрификации). Последние, не связанные тканями растений (и далее по пищевой цепи травоядными и хищниками), недолго остаются в почве. Большинство нитратов и нитритов хорошо растворимы, поэтому они смываются водой и в конце концов попадают в мировой океан (этот поток оценивается в 2,5—8·107 т/год).
Азот, включённый в ткани растений и животных, после их гибели подвергается аммонификации (разложению содержащих азот сложных соединений с выделением аммиака и ионов аммония) и денитрификации, то есть выделению атомарного азота, а также его оксидов. Эти процессы целиком происходят благодаря деятельности микроорганизмов в аэробных и анаэробных условиях.
В отсутствие деятельности человека процессы связывания азота и нитрификации практически полностью уравновешены противоположными реакциями денитрификации. Часть азота поступает в атмосферу из мантии с извержениями вулканов, часть прочно фиксируется в почвах и глинистых минералах, кроме того, постоянно идёт утечка азота из верхних слоёв атмосферы в межпланетное пространство.
Фосфор. Химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего периода периодической системы Д. И. Менделеева; имеет атомный номер 15. Один из распространённых элементов земной коры: его содержание составляет 0,08—0,09 % её массы. Концентрация в морской воде 0,07 мг/л. В свободном состоянии не встречается из-за высокой химической активности. Образует около 190 минералов, важнейшими из которых являются апатит Ca5(PO4)3(F, Cl, OH), фосфорит и другие. Фосфор содержится во всех частях зелёных растений, ещё больше его в плодах и семенах. Содержится в животных тканях, входит в состав белков и других важнейших органических соединений (АТФ, ДНК), является элементом жизни.
Соединения фосфора. Фосфор образует два легко летучих водородных соединения: газообразный при обычной температуре фосфористый водород − фосфин РН3 и жидкий при обычной температуре фосфористый водород − дифосфин Р2Н4. Является ли самостоятельным соединением так называемый «твердый фосфористый водород» примерного состава Р2Н или Р12Н6, еще не установлено.Фосфин РН3, как и NH3, дает соли с кислотами, особенно с галогеноводородными (соли фосфония). Но эти соли значительно менее устойчивы, чем соли аммония; например, йодид фосфония, образующийся по уравнению РН3 + НI = РН4I − (бесцветные, тетрагональные кристаллы, возгоняющиеся при 80 °С), разлагается водой. Бромид фосфония РН4Вr (т. возг. 30 °C) и хлорид фосфония РН4С1 (т. возг. −28 °С), несмотря на низкую температуру сублимации, в парах полностью разлагаются на РН3 и галогеноводород.Р2Н4 не соединяется с кислотами; твердому фосфористому водороду Р2Н приписывают способность слизывать вещества основного характера, например, пиперидин.
Фосфор легко окисляется кислородом:
 (с избытком кислорода)
(с избытком кислорода)
 (при медленном окислении или при недостатке кислорода)
(при медленном окислении или при недостатке кислорода)
Взаимодействует со многими простыми веществами — галогенами, серой, некоторыми металлами, проявляя окислительные и восстановительные свойства:
с металлами — окислитель, образует фосфиды:

фосфиды разлагаются водой и кислотами с образованием фосфина
с неметаллами — восстановитель:


Биологическая роль фосфора. Фосфор присутствует в живых клетках в виде орто- и пирофосфорной кислот, входит в состав нуклеотидов, нуклеиновых кислот, фосфопротеидов, фосфолипидов, коферментов, ферментов. Кости человека состоят из гидроксилапатита 3Са3(РО4)3·Ca(OH)2. В состав зубной эмали входит фторапатит. Основную роль в превращениях соединений фосфора в организме человека и животных играет печень. Обмен фосфорных соединений регулируется гормонами и витамином D. Суточная потребность человека в фосфоре 800—1500 мг. При недостатке фосфора в организме развиваются различные заболевания костей.
Поиск по сайту: