 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Современная теория зародышеобразования в адсорбированной фазе при физическом осаждении паров
В соответствие с этой теорией при осаждении пара на твердой поверхности зародышеобразование адсорбированной фазы, т.е. формирование устойчиво растущих ее частиц происходит при некоторых относительно высоких значениях плотности адсорбционного слоя. В общем случае возможны два основных механизма образования таких частиц (зародышей):
Первый классический механизм гомогенного зародышеобразования заключается в образовании зародышей вследствие флуктуаций плотности адсорбированных атомов. При этом образование устойчивых частиц (островков новой фазы) на поверхности, как и в объемной теории, происходит в результате случайного взаимодействия атомов между собой, приводящего к возникновению достаточно больших по размеру и устойчивых при данных условиях ассоциатов.
Второй основной механизм заключается в зародышеобразовании на дефектах - участках поверхности с более высоким потенциалом взаимодействия. Закрепленные на поверхностном дефекте атомы последовательно присоединяют к себе диффундирующие частицы, и в результате формируется система стабильных ассоциатов, плотность которых и их поверхностное распределение коррелирует с параметрами поверхностной дефектности.
Считается, что зародышеобразование вследствие флуктуации плотности адсорбированных атомов наиболее вероятно при осаждении на поверхность, имеющую низкую температуру. При высокой температуре поверхности и относительно низкой плотности потока поступающих на поверхность атомов зародышеобразование проявляется преимущественно на дефектах. При определенных условиях и режимах процесса осаждения первый и второй механизмы могут протекать одновременно.
Зародышеобразование по флуктуационному механизму происходит тогда, когда на поверхности подложки образуется адсорбционная фаза с плотностью, превышающей критическую: 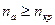 . При этом флуктуация плотности:
. При этом флуктуация плотности: 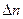 а ~
а ~ 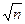 а, а критическая плотность адсорбированных атомов зависит от природы материала подложки и ее температуры и связана с кинетикой адсорбции потока пара, падающего на подложку. При больших временах осаждения, когда на поверхности образуется равновесная плотность адсорбированных атомов, условие зародышеобразования имеет вид:
а, а критическая плотность адсорбированных атомов зависит от природы материала подложки и ее температуры и связана с кинетикой адсорбции потока пара, падающего на подложку. При больших временах осаждения, когда на поверхности образуется равновесная плотность адсорбированных атомов, условие зародышеобразования имеет вид: 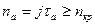 , где j - плотность потока атомов, ат./(м2с), tа=tоexp(Eа/kT) – время жизни в адсорбированном состоянии, tо =10-13…10-12с; Eа – энергия связи с поверхностью; k – постоянная Больцмана (см. выше раздел 2.1.2. Адсорбция). Тогда плотность потока, при которой протекает процесс зародышеобразования, может быть получена из условия:
, где j - плотность потока атомов, ат./(м2с), tа=tоexp(Eа/kT) – время жизни в адсорбированном состоянии, tо =10-13…10-12с; Eа – энергия связи с поверхностью; k – постоянная Больцмана (см. выше раздел 2.1.2. Адсорбция). Тогда плотность потока, при которой протекает процесс зародышеобразования, может быть получена из условия: 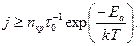 Данное условие графически представлено на рисунке 2.11а как область выше кривой в координатах режима осаждения плотность потока – температура.
Данное условие графически представлено на рисунке 2.11а как область выше кривой в координатах режима осаждения плотность потока – температура.
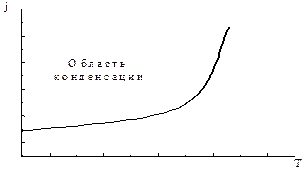
Рисунок 2.11а. Область режимов осаждения, при которых возможно зародышеобразование и, соответственно, конденсация пара.
Анализ этих соотношений по отношению к плотности потока падающих частиц при заданной температуре показывает, что:
 1) существуют некоторые пороговые значения плотности потока падающих частиц jк, ниже которых зарождение конденсированной фазы не происходит;
1) существуют некоторые пороговые значения плотности потока падающих частиц jк, ниже которых зарождение конденсированной фазы не происходит;
2) пороговое значение jк зависит от температуры: при понижении температуры поверхности подложки пороговое значение jк уменьшается.
Аналогичные выводы можно сделать по отношению к температуре при заданной плотности потока. Максимальное значение температуры Tк, при которой происходит конденсация, получило название критической температуры или температуры Кнудсена. Значение Tк зависит, в основном, от природы и плотности падающих частиц, а также от состояния поверхности подложки. Наличие в падающем на поверхность потоке или в адсорбированном слое атомных ассоциатов (кластеров из нескольких атомов) способствует процессам зародышеобразования, т. к. при этом увеличивается время жизни в адсорбированном состоянии τа и снижается вероятность перехода частиц в газовую фазу.
В процессе дальнейшего осаждения атомов происходит рост  образовавшихся зародышей. Присоединение атомов к зародышам осуществляется двумя способами:
образовавшихся зародышей. Присоединение атомов к зародышам осуществляется двумя способами:
1) Непосредственный захват атомов из газовой фазы. Данный перенос не является определяющим на начальных стадиях осаждения, когда размер зародыша мал. Он доминирует на поздних стадиях роста островковой пленки. Доля атомов, присоединяемых к зародышу таким путем равна: α =(NзSr)-1,где Sr~πR23 –средняя площадь отдельного зародыша; R3 – радиус зародыша; N-плотность зародышей. Осажденные на поверхности атомы в условиях проявления сильной связи их с поверхностью формируют купол частицы, определяют ее внешнюю форму (сферическую, эллипсовидную, пирамидальную или какую-то другую).
2) Захват зародышем диффундирующих по поверхности подложки адсорбированных атомов. Зародыши являются стоком диффундирующих атомов. Вокруг зародыша образуется зона с градиентом плотности адсорбированных атомов (Рис. 2.11б), который и определяет направление и плотность потока диффузии. Ширина градиентной зоны соизмерима с длиной диффузионного пробега адатомов.
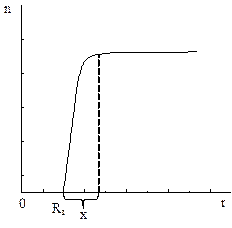
Рисунок 2.11б. Зависимость плотности атомов от расстояния до центра зародыша
Для характеристики процесса осаждения используется зона захвата зародыша А(t,Rз) – эффективный участок площади поверхности, при попадании на который атом неизбежно конденсируется, т.е. захватывается зародышем. С учетом возможности одновременного роста зародышей по двум рассмотренным выше механизмам эффективная площадь зоны захвата приближенно может быть оценена с помощью выражения: 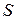
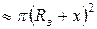 .
.
Для характеристики кинетики процесса осаждения атомов вводится коэффициент конденсации. Различают:
· мгновенный коэффициент конденсации: 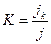 ;
; 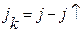 ;
; 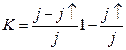
где 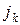 - плотность потока атомов, присоединенных к растущим зародышам в данный момент времени за дифференциально малый его промежуток;
- плотность потока атомов, присоединенных к растущим зародышам в данный момент времени за дифференциально малый его промежуток; 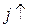 - плотность потока атомов, реиспаренных в газовую фазу с поверхности;
- плотность потока атомов, реиспаренных в газовую фазу с поверхности;
· интегральный коэффициент конденсации: 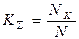 ,
,
где N, Nк – число атомов, поступивших на поверхность и претерпевших конденсацию на поверхности в течение времени t соответственно.
В общем случае значение 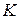 зависит от плотности зародышей и средней площади их зоны захвата:
зависит от плотности зародышей и средней площади их зоны захвата: 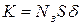 , где
, где 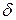 – коэффициент, который учитывает перекрытие зон захвата.
– коэффициент, который учитывает перекрытие зон захвата.
Как правило, на поверхности неорганических материалов зародыши образуются мгновенно, и их плотность в процессе роста меняется незначительно. При осаждении же на поверхность полимерных материалов вследствие подвижности адсорбционно-активных групп в поверхностном слое полимера плотность зародышей, как правило, возрастает в процессе осаждения. Характер изменения плотности зародышей в процессе вакуумной металлизации полимеров сказывается на зависимости коэффициента конденсации от температуры поверхности подложки. Отметим, что для неорганических материалов коэффициент конденсации при нагревании подложки монотонно уменьшается вследствие возрастания вероятности реиспарения адатомов.
При осаждении атомов металла на поверхности неполярных полимеров при T>Tс (Tс –температура стеклования полимера) вследствие сегментальной подвижности макромолекул на поверхности возрастает плотность активных центров, имеющих высокий потенциал взаимодействия и способных выполнять роль стоков адсорбированных атомов. Как следствие этого, при нагревании полимера имеет место возрастание коэффициента конденсации. При Т>Тmax преобладающим становится процесс термической активации процесса реиспарения, и в результате наблюдается снижение К. При достаточно высокой температуре полимера, когда происходит его плавление (Т >Тпл), резко возрастает адсорбционная активность поверхности, имеет место диффузия адатомов в объем подложки и наблюдается повышение коэффициента конденсации.
Кинетика конденсации атомов металла в условиях непрерывной генерации зародышей на поверхности полимеров, может быть описана в рамках релаксационно-диффузионной теории конденсации. В соответствии с представлениями данной теории полимер рассматривается как система связанных между собой макромолекул, движение кинетических элементов и сложный химический состав которых порождают неоднородность адсорбционных свойств поверхности, их изменение во времени. Особый интерес представляет выход на поверхность участков макромолекул, которые обладают высокой активностью и способны при взаимодействии с адатомами металла образовывать достаточно стабильные комплексы. Эти комплексы можно рассматривать как потенциальные центры зародышеобразования конденсированной фазы. Основное уравнение релаксационно-диффузионной теории конденсации: 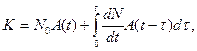 где
где 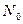 – плотность зародышей в начальный момент времени (
– плотность зародышей в начальный момент времени (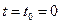 );
); 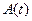 – площадь средней зоны захвата зародыша в момент времени t;
– площадь средней зоны захвата зародыша в момент времени t; 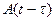 –площадь зоны захвата зародыша, образовавшегося через время
–площадь зоны захвата зародыша, образовавшегося через время 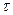 , отсчитанное от начала процесса осаждения и находящегося на поверхности время
, отсчитанное от начала процесса осаждения и находящегося на поверхности время 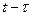 .
.
Таким образом, первое слагаемое релаксационного уравнения определяет эффективную (суммарную) зону захвата зародышей, образовавшихся в начальный момент времени, второе слагаемое описывает вклад в коэффициент конденсации процессов присоединения атомов к зародышам, которые образовались в процессе осаждения.
Приведенное выше релаксационное уравнение описывает изменение коэффициента конденсации в процессе осаждения и его зависимость от температуры поверхности подложки, плотности потока падающих на нее атомов.
В рамках релаксационно-диффузионной теории конденсации дано объяснение наблюдаемых при металлизации полимеров эффектов: селективное осаждение металлического покрытия на аморфных участках поверхности; влияние механических напряжений в поверхностных слоях на коэффициент конденсации; явление передачи через тонкие полимерные слои адсорбционной активности подложки и др.
2.3. Формирование сплошного слоя или покрытия в результате взаимодействия зародышей между собой, их срастание (коалесценция, созревание Освальда)и дальнейший рост слоя или покрытия.
Коалесценция является одной из основных стадий роста пленки. Она протекает после того, как на поверхности образуются частицы конденсированной фазы, плотность и степень заполнения поверхности которых достигают критических значений. Островки конденсата по мере их роста вступают в контакт друг с другом и, в итоге, образуют непрерывную пространственную сетку, закономерности формирования которой описывается теорией перколяции и геометрии фракталов. На более глубоких стадиях слияние островков приводит к формированию сплошного (монолитного) слоя или покрытия.
Процесс слияния островковых структур вначале протекает очень быстро, а затем после возникновения непрерывной пространственной сетки существенно замедляется. В процессе взаимодействия таких структур при достаточно высоких температурах возможно их перемещение по поверхности. В этом случае на поверхности образуются участки, свободные от конденсированной фазы и на которых возможно протекание процессов вторичного зародышеобразования. На стадии коалесценции, в зависимости от условий осаждения и природы материалов покрытия и подложки, размер частиц составляет 50…500 Å.
Предполагается, что процесс коалесценции при достаточно высокой температуре подложки подобен процессу слияния двух капель жидкости. Слияние жидкоподобных островков происходит быстро, и уже за время t=0,1 с образуется большая частица. В этом случае процесс коалесценции происходит, в основном, в результате протекания процессов объемной диффузии. Данный процесс является энергетически выгодными, т.к. 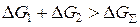 , где
, где 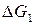 и
и 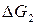 –свободная энергия Гиббса первого и второго островков; ∆G∑– свободная энергия Гиббса образовавшейся крупной частицы.
–свободная энергия Гиббса первого и второго островков; ∆G∑– свободная энергия Гиббса образовавшейся крупной частицы.
Стадия коалесценции может наблюдаться и при взаимодействии кристаллических микрочастиц. В этом случае основным механизмом массопереноса является поверхностная диффузия. Для кристаллических пленок стадия коалесценции является очень важной, т.к. она определяет дисперсность покрытия, характер распределения и плотность дефектов, структуру межкристаллитных зон.
В общем случае кинетика слияния островков может быть описана эмпирическим уравнением 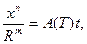 где x – радиус зоны контакта (Рис. 2.12), n, m – характеристики коалесценции, зависящие от механизма слияния (если основной механизм слияния – объемная диффузия, то n=5; m=2, если же основной механизм переноса массы – поверхностная диффузия, то n=7; m=3); A(t) – кинетическая функция, зависящая от температуры поверхности и физических констант материалов покрытия и подложки.
где x – радиус зоны контакта (Рис. 2.12), n, m – характеристики коалесценции, зависящие от механизма слияния (если основной механизм слияния – объемная диффузия, то n=5; m=2, если же основной механизм переноса массы – поверхностная диффузия, то n=7; m=3); A(t) – кинетическая функция, зависящая от температуры поверхности и физических констант материалов покрытия и подложки.
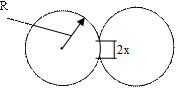
Рисунок 1.12 – Схема контакта двух частиц при коалесценции
Cчитается, что на начальной стадии рост шейки происходят, в основном, в результате переноса уже осажденного материала, а на поздних стадиях слияние обусловлено преимущественным осаждением вновь поступающих атомов на участки с повышенной кривизной.
В ряде случаев, например, при осаждении покрытия из ионизированных потоков на диэлектрические подложки существенное влияние на коалесценцию оказывают электростатические взаимодействия, и эффективным технологическим приемом ее регулирования является создание внешнего электрического поля.
После формирования монолитного слоя или покрытия дальнейший его рост происходит за счет адсорбции и конденсации пара.
2. Процессы химического осаждения из газовой фазы (СVD).
Химическое газофазное нанесение покрытий или осаждения слоев осуществляется путем адсорбции одного или нескольких летучих реакционноспосбных соединений (прекурсоров) на нагретой поверхности подложки, где они вступают в реакции между собой или разлагаются, образуя твердые высокочистые пленки с заданными свойствами. При этом часто образуются побочные летучие продукты, которые удаляются потоком газа, выходящим из реакционной камеры (Рис.2.13). Основой метода химического осаждения служат гетерогенные химические реакции в парогазовой среде вблизи поверхности подложки, в результате которых образуются требуемые материалы. Исходные соединения находятся в газообразном состоянии и смешаны с инертным газом-носителем.
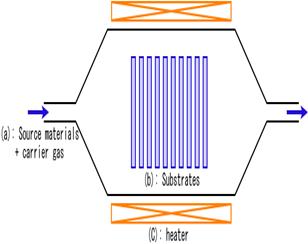
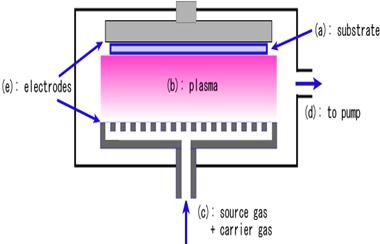
Рис.2.13. Схемы реакционных камердля химического осаждения из газовой фазы с горячими стенками и массовой загрузкой подложек (а) (Souce materials +carrier gas –прекурсор +газ-носитель; Substrates - подложки; Heater - нагреватель) и стимулированного плазмой химического осаждения (б) (electrodes - электроды; substrate – подложка; to pump - к насосу; source gas +carrier gas – газ-прекурсор +газ-носитель).
Благодаря высокой интенсивности процессов массопереноса, присущих газообразным средам, метод химического осаждения обладает исключительной "кроющей" способностью. Возможность обеспечивать высокие массовые потоки исходных соединений в газообразном состоянии к покрываемой поверхности позволяет реализовать высокую производительность процессов нанесения покрытия, в которых скорость роста может достигать от нескольких сотен микрон в час до нескольких миллиметров в час. Высокая поверхностная подвижность адсорбированных соединений позволяет в этих процессах получать покрытия с плотностью, близкой к теоретической, при температурах ~ 0,15-0,3 от температуры плавления материала, что недоступно для других методов нанесения покрытий, а также формировать совершенные эпитаксиальные покрытия. Особенно эффективными являются методы плазмохимического газофазного осаждения (ПХГФО)или стимулированного плазмой химического осаждения (ПХО) - Plasma Enhanced or Assisted (РЕ or PA) CVD (см. Рис.2.6б). В технологии плазмохимического осаждения используют высокочастотную газоразрядную плазму для разложения реакционного газа на активные радикалы или ионы. Применение различных приемов возбуждения плазмы в реакционном объёме и управление её параметрами позволяет интенсифицировать процессы роста покрытий, проводить осаждение аморфных и поликристаллических пленок при значительно более низких температурах подложки, делает более управляемыми процессы формирования заданного микрорельефа, структуры, примесного состава и других характеристик покрытия по сравнению с аналогичными процессами при использовании методов химического осаждения из газовой фазы, основанных на термическом разложении реакционного газа.
Таким образом, среди известных методов нанесения покрытий высокого качества плазмо-химические методы осаждения находятся вне конкуренции в большинстве случаев, когда необходимо:
· наносить равномерные по толщине, высокоплотные покрытия на изделия сложной формы с развитой поверхностью, в том числе, на внутренние поверхности, протяженные и глухие полости, отверстия;
- получать покрытия из тугоплавких, труднообрабатываемых металлов, сплавов и соединений с плотностью близкой к теоретической и высокой чистоты, формировать из них самонесущие изделия различной геометрии.
- наносить покрытия на порошки и другие сыпучие материалы, пропитывать (уплотнять) пористые структуры.
Химические и плазмо-химические методы осаждения могут осуществляться при атмосферном давлении - Atmospheric рressure (AP) CVD), при пониженном давлении - Low pressure (LP) CVD, либо при сверхвысоком вакууме (ниже 10−6 Па или примерно 10−8 мм рт. ст.) - Ultra high vacuum (UHV) CVD. Понижение давления во всех случаях снижает вероятность нежелательных реакций в газовой фазе и ведёт к более равномерному осаждению плёнки на подложку. Поэтому большинство современных CVD-установок — либо LPCVD, либо UHVCVD.
На рис. 2.14 приведена принципиальная схема установки плазмохимического осаждения тонких неорганических слоев или покрытий, в частности нитрида кремния (НК). Установка состоит из откачиваемого до остаточного давления ~ 10-6 Торр (мм рт. ст.) реактора, объединенного с электронным циклотронным резонансным (ЭЦР) плазменным источником и газовой системой для подачи реакционных газов. ЭЦР-плазменный источник представляет собой охлаждаемую резонансную камеру, снабженную магнитной системой на основе сдвоенных катушек Гельмгольца и объединенную при помощи волноводного тракта с магнетронным блоком, генерирующим СВЧ излучение частотой 2,45 ГГц (не путать с магнетронным распылителем).
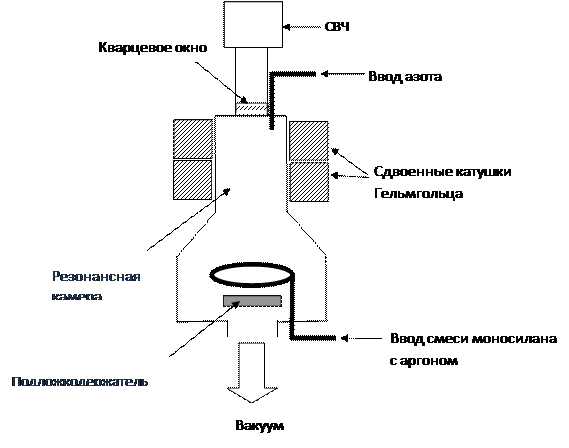
Рис. 2.14. Принципиальная схема установки плазмохимического осаждения тонких неорганических слоев или покрытий.
Плазма возбуждается СВЧ излучением, вводимым по волноводному тракту через кварцевое окно в резонансную камеру, при условии совпадения его частоты с частотой вращения электронов в магнитном поле, создаваемом магнитной системой, т.е. при проявлении эффекта ЭЦР. Эта частота определяется по уравнению ω=eH/mec, где H – интенсивность магнитного поля, e – заряд электрона, me – масса электрона, c – скорость света в вакууме.
Для синтеза НК применяют газовую смесь моносилана SiH4 с газом-носителем аргоном Ar (25 об. % моносилана и 75 об. % аргона) и азотом N2 или аммиаком NH3. Обобщенные схемы реакций синтеза
НК выглядят следующим образом: х SiH4 + у/2 N2 →SixNyHz + (4х-z)/2 H2 и х SiH4 + у NH3 →SixNyHz + (4х+3у- z)/2 H2. При этом азот или аммиак вводится в резонансную камеру, а смесь моносилана с аргоном - в область подложки через газовое кольцо, локализуя таким образом синтез НК у подложки. В зависимости от величины магнитной индукции возле кварцевого окна возможны различные формы потока (режимы) плазмы: узкий, круговой, однородный. Они характеризуются различным распределением плотности плазмы по радиальному профилю резонансной камеры. Так, узкий и круговой режимы характеризуется повышенной плотностью плазмы в середине и на краях резонансной камеры соответственно. Однородный режим характеризуется приблизительно одинаковой плотностью плазмы по всему радиальному профилю резонансной камеры.
Основное соединение кремния с азотом Si3N4 (43 ат. % кремния и 57 ат. % азота), соответствующее стехиометрическому соотношению компонентов, образует тригональную (α) и гексагональную (β) кристаллические сингонии. В блоке Si3N4 обычно образует поликристаллическую структуру, обладающую высокими физико-механическими и электрофизическими характеристиками. Так, модуль упругости поликристаллического Si3N4 составляет величину порядка 304 ГПа. При синтезе НК осаждением из газовой фазы получают, в основном, аморфные слои, в химический состав которых, помимо кремния и азота, и, соответственно, ковалентных связей Si – N и Si – Si, входят также побочные атомы водорода и кислорода, образующие ковалентные связи с кремнием и азотом (Si – H, Si – O, N – H, N - O). Количество побочных атомов и связей определяется как условиями осаждения (технологическими режимами), так и общей технологической культурой.
Кроме трудной воспроизводимости состава структуры осажденного слоя НК большую проблему при этом составляют возникающие остаточные (внутренние) напряжения. Общепринята модель, в рамках которой остаточные напряжения в тонких пленках представляются как сумма термической и структурной составляющей. Термические напряжения однородны по толщине и возникают из-за разности КТЛР пленки и подложки. Они определяются по соотношению: 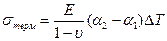 , где a1 и a2 – коэффициенты термического линейного расширения (КТЛР) материалов подложки и пленки, Е - модуль Юнга подложки, ν – коэффициент Пуассона, ΔT– разность между температурой процесса осаждения и комнатной температурой. Структурные напряжения неоднородны по толщине и возникают в результате изменения плотности или размеров зерен по толщине пленки, из-за неоднородного распределения дефектов и др. Общая величина остаточных напряжений в тонких пленках при этом представляется в виде полиномиальной функции:
, где a1 и a2 – коэффициенты термического линейного расширения (КТЛР) материалов подложки и пленки, Е - модуль Юнга подложки, ν – коэффициент Пуассона, ΔT– разность между температурой процесса осаждения и комнатной температурой. Структурные напряжения неоднородны по толщине и возникают в результате изменения плотности или размеров зерен по толщине пленки, из-за неоднородного распределения дефектов и др. Общая величина остаточных напряжений в тонких пленках при этом представляется в виде полиномиальной функции: 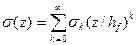 , где z – расстояние от нижнего края пленки, hf – суммарная толщина пленки [106]. При этом, k = 0 соответствует однородным термическим напряжениям в пленке, а k = 1 - линейному распределению структурной составляющей остаточных напряжений по толщине слоя.
, где z – расстояние от нижнего края пленки, hf – суммарная толщина пленки [106]. При этом, k = 0 соответствует однородным термическим напряжениям в пленке, а k = 1 - линейному распределению структурной составляющей остаточных напряжений по толщине слоя.
Разновидностью метода химического осаждения является метод металлоорганического химического газофазного осаждения - Metalorganic CVD, называемый часто металлорганической эпитаксией из газовой фазы - Metalorganic vapour phase epitaxy (MOVPE), в котором используются металлоорганические летучие прекурсоры и который позволяет получать моно- или поликристаллические эпитаксиальные тонкие сдли, в первую очередь из термодинамичеки метастабильных сплавов. Этот метод близок к молекулярно-лучевой эпитаксии, однако в нем рост кристаллических слоев при получении многослойных структур осуществляются не в результате физической адсорбции, а в результате очень сложных химических и адсорбционных процессов. Кроме того, этот процесс проводится не при глубоком вакууме, а в газовой фазе при сравнительно высоеом давлен (от10 до 760 торр).
Среди химических методов осаждения в последнее время довольно широко развиваются методы распылительного пиролиза, или химического осаждения с использованием прямой инжекции жидкого прекурсора или его раствора непосредственно на подложку - Direct liquid injection (DLI) CVD или распыления на разогретые подложки аэрозолей - Aerosol Assisted (AA) CVD, которые могут создаваться из растворов, в частности,, в воде термически разлагающихся солей соответствующих компонентов сложных или простых оксидов различными способами, например, под действием ультразвука. Во втором случае только часть исходных компонентов будет подвергаться пиролизу после достижения частицей аэрозоля температуры подложки, В силу разной летучести и устойчивости к нагреванию компоненты могут улетучиваться с различной скоростью или разлагаться ещё на подлете к подложке и оседать уже в виде твердых частиц и агломератов. Такие явление могут приводить к снижению химической и фазовой гомогенности пленок, что требует корректировки состав исходных растворов, повышая в них долю летучих компонентов. Введение в рабочие растворы растворимых в данном растворителе (например, воде) полимеров позволяет снизить отрицательное влияние указанных факторов, т.к. температуры разложения солей нивелируются.
К химическим методам осаждения относят также нанесение тонких полимерных слоев или покрытий, в частности поли-пара-ксилилена, фторорганических и других полимеров полимеризацией мономеров в газовой фазе (см. курс «Химия полимеров).
На практике часто используется гибридное физико-химическое осаждение из газовой фазы - Hybrid Physical-Chemical Vapor Deposition (HPCVD)) — процесс, сочетающий и химические превращения прекурсоров, и испарение твёрдого материала.
Химическое осаждение из газовой фазы чаще всего используется для нанесения неорганических (неметаллических и металлических) слоев и покрытий. Исходными реагентами при этом служат неорганические и элемент- (чаще всего кремний-) или металл-органические газообразные соединения, взаимодействующие с другими составляющими смесей (водородом, азотом, аммиаком, окисью углерода и т.п.) по сложным схемам, сочетающим реакции разложения или пиролиза, восстановления и/или окисления. Например, в технологии производства МЭМС методами поверхностных микрообработок используются следующие схемы реакций химического осаждения:
· поликристаллического кремния: SiH3Cl → Si + H2 + HCl; SiH4 → Si + 2 H2
· диоксида кремния: SiH4 + O2 → SiO2 + 2 H2; SiCl2H2 + 2 N2O → SiO2 + 2 N2 + 2 HCl; Si(OC2H5)4 → SiO2 + побочные продукты
· нитрида кремния: 3 SiH4 + 4 NH3 → Si3N4 + 12 H2; 3 SiCl2H2 + 4 NH3 → Si3N4 + 6 HCl + 6 H2
· гидрированного нитрида кремния: 2 SiH4 + N2 → 2 SiNH + 3 H2; SiH4 + NH3 → SiNH + 3 H2
· вольфрама: WF6 → W + 3 F2; WF6 + 3 H2 → W + 6 HF
· Mo, Ta и Ti: 2 MCl5 + 5 H2 → 2 M + 10 HCl
· нитрида титана: TiCl4 + N2 + 2H2 ® TiN + 4HCl
· арсенида галлия: 6GaAs+6HCI «As4+GaCl+3H2
· графита: СН4→ графит.
Очевидно, что механизм, кинетика и глубина прохождения этих реакций оказывают значительное влияние на механизм и кинетику элементарных физических процессов формирования тонких слоев или покрытий и, соответственно, на их структуру и свойства, резко усложняя и затрудняя их теоретическое описание.
Специфическим методом химического осаждения (CVD) является метод химических транспортных реакций (ХТР), с помощью которого получают тонкие слои и покрытия вольфрама, молибдена, ниобия и других тугоплавких металлов, которые получить другими методами невозможно или очень трудно. Данные металлы имеют ОЦК решетку, высокую энергию межатомных связей и, как следствие, обладают высокой твердостью, прочностью, температурой плавления, хорошо проводят тепло и электрический ток.
Суть метода ХТР заключается в следующем. В качестве исходного материала используются легколетучие химические соединения, например, галогениды металлов. Эти соединения испаряются, переносятся через газовую фазу, осаждаются на поверхности с последующим восстановлением или же разложением при температуре значительно ниже температуры плавления металла (при 100…700 0С). В результате на поверхности выделяется твердое веществ (металл), которое и образует покрытие. Схема процесса представлена на рис. 2.15. Например, процесс нанесения покрытий вольфрама путем восстановления водородом гексафторида вольфрама протекает в соответствии с реакцией: WF6 + 3H2 ® W↓ + 6HF↑.
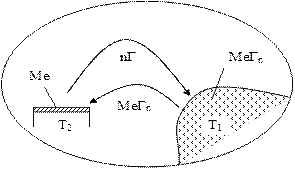
Рис. 2.15. Схема осаждения покрытия методом ХТР в замкнутом реакторе
При температуре Т1 происходит испарение летучих химических соединений MeГn. Подложка, на которую наносится покрытие, имеет температуру Т2. Образование твердого осадка (покрытия) происходит в результате протекания одной из следующих основных реакций.
1. Реакция диспропорционирования, т. е. реакция смены валентности металла (с n на m):
n/mМеГn (пар) ®(n/m-1) Ме (тв. сост.) ¯+ МеГm (газ) . Здесь Ме – металл; Г–галоген.
2. Реакция термической диссоциации:
МеГn (пар) ® Ме (тв.)¯ + nГ(газ).
3. Реакция восстановления соединений металла водородом:
МеГn (газ) + n/2H2 ® Me(тв.)¯ + nHГ(газ) .
Иногда используют одновременно протекающие реакции, например, диссоциации и восстановления. В результате использования таких процессов удается значительно снизить температурный режим осаждения покрытия по сравнению с другими методами формирования, например, методом резистивного испарения.
С физико-химической точки зрения основные процессы, протекающие при реализации метода ХТР, такие же, как и при получении покрытий методом испарения.
В формировании покрытий методом ХТР можно выделить следующие основные стадии:
1. Подготовка технологического вещества (перевод его в газовую фазу, очистка и т.д.).
2. Подача газообразных, реагирующих компонентов к поверхности.
3. Адсорбция газообразных соединений.
4. Протекание реакций на поверхности.
5. Десорбция газообразных продуктов реакции.
В последнее время нанесение покрытий методом ХТР осуществляется преимущественно в прямоточных реакторах, в которых размещают нагретую до температуры Т2 подложку и к ее поверхности подают пары химических соединений и газ-носитель (рис. 2.16).
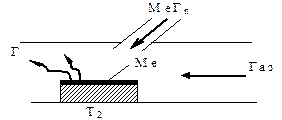
Рисунок 2.16. Схема осаждения покрытия методом ХТР в прямоточном реакторе
При данной схеме осаждения происходит непрерывное удаление продуктов реакции из зона осаждения, что способствует повышению качества формирующегося покрытия.
В общем случае толщина покрытия, скорость его роста зависят от значения температуры Т2, общего давления в системе и парциального давления химических соединений, скорости продува реактора.
Характер и направление химических реакций определяются изменением свободной энергии Гиббса. Повышение температуры реакции эндотермических реакций приводит к увеличению константы равновесия и, соответственно, к увеличению выхода продуктов реакции.
Реакции осаждения покрытия могут протекать как в кинетическом, так и в диффузионном режимах. При реализации кинетического режима выход продукта определяется скоростью протекания химических процессов, зависит от энергии активации соответствующей химической реакции. При диффузионном режиме скорость реакции определяется скоростью подвода реагирующих компонентов.
При низких температурах Т2 реакция выделения металла на поверхности детали протекает преимущественно в кинетическом режиме (концентрация исходных компонент существенно не влияет на скорость роста покрытия), и образующиеся слои имеют мелкозернистую структуру. При повышении температуры скорость реакции возрастает и, соответственно, возрастает скорость роста покрытия; при этом образуются слои с крупнозернистой структурой (реализуется диффузионный режим: скорость роста пленки сильно зависит от скорости подачи газообразных продуктов к поверхности подложки и десорбции продуктов реакции с подложки). Дальнейшее повышение температуры приводит к тому, что реакция выделения металла протекает не только на поверхности подложки (детали), но и в объеме, т. е. осуществляется гомогенный режим химической реакции. В этом случае уменьшается скорость роста покрытия, наблюдаются нежелательные потери металла. Таким образом, температура поверхности оказывает экстремальное влияние на скорость роста покрытий, определяет их структурное состояние.
К числу основных параметров, влияющих на скорость роста покрытия, следует отнести скорость подачи продуктов реакции. При повышении скорости подачи у поверхности подложки повышается давление паров, что вызывает увеличение плотности зародышей. В свою очередь это определяет образование сплошного слоя при его меньшей эффективной толщине. При этом формируются покрытия с более дисперсной структурой.
Существенное влияние на структуру и скорость роста покрытий оказывают адсорбированные на подложке газовые слои, которые изменяют значение энергии адсорбции, условия зародышеобразования и диффузию выделяющихся атомов металла. В ряде случаев наблюдается химическое взаимодействие атомов металла с атомами адсорбированных слоев.
Свойства и структура покрытий зависят и от их толщины. Как правило, в слоях, непосредственно прилегающих к поверхности подложки, наблюдается образование и рост ориентированных структур, в процессе роста покрытия ориентация кристаллических образований становится менее выраженной.
Очень важной проблемой при нанесении покрытий методом ХТР является обеспечение необходимой прочности адгезионного соединения. С целью ее повышения, снижения внутренних механических напряжений при осаждении покрытий методом ХТР используют следующие технологические приемы.
1. Проводят тщательную многостадийную предварительную подготовку поверхности. На первом этапе осуществляют механическую очистку поверхности. Затем с целью удаления оксидных слоев проводят химическое и электрохимическое травление. В ряде случаев высокая адгезия достигается при применении ионной обработки, УЗ-очистки и других методов поверхностной обработки. Наиболее эффективным методом удаления оксидов и гидрооксидов является восстановление металлов в результате прогрева подложки в среде сухого водорода.
2. Формируют промежуточные адгезионно-активные слои. Промежуточные слои имеют отличную от материала основы природу и могут быть образованы в результате сегрегации (диффузии отдельных компонент сплава из объема на поверхность при нагреве или ионной обработке).
4. Осуществляют термообработку покрытия. При нагреве интенсифицируются диффузионные процессы, в итоге образуются переходные слои, которые способствуют повышению адгезионной прочности. При этом надо учитывать, что при определенных условиях возможно образование хрупкой интерметаллической фазы. С целью предотвращения образования этой фазы на поверхность детали наносят антидиффузионный промежуточный слой толщиной 1…5 мкм, например, из оксидов, силицидов тугоплавких металлов.
В технологических процессах получения тонких слоев и покрытий методами химического осаждения паров часто используется плазменное стимулирование процессов. При этом используется, как правило, низкоэнергетичная (низкоэнтальпийная) плазма, которая характеризуется относительно невысокой температурой и низкой степенью ионизации. Плазма содержит свободные электроны, ионы, нейтроны, частицы, которые находятся в состоянии непрерывного движения, сталкиваются между собой, что приводит в общем случае к генерации или рекомбинации реакционно-способных частиц. Наиболее широко используется плазма тлеющего разряда, которая явлется неизотермической: температуры электронов и ионов неодинаковы, поэтому для ее поддержания нужен постоянный внешний подвод энергии.
В общем случае все элементарные процессы, протекающие в плазме, в зависимости от состояния взаимодействующих частиц можно разделить:
- на элементарные процессы, протекающие с участием только нейтральных атомов. К их числу относят, например, диссоциацию химических соединений: АВ→ А+В. При их протекании зарядка этих частиц не наблюдается. В данную группу входят также обменные процессы, протекающие по схеме АВ+С→АС+В;
- на процессы с участием возбужденных или электрически заряженных частиц. В эту группу включают следующие основные элементарные акты:
· возбуждение частиц;
· ионизация атомов и молекул;
· рекомбинация заряженных и возбужденных частиц;
· диффузия.
Основной механизм данных процессов заключается в изменении состояния частиц в результате их столкновения. В общем случае различают столкновения упругие и неупругие. Неупругие, в свою очередь, разделяют на неупругие столкновения первого и второго рода. Столкновения называют упругими, если при протекании выполняются законы сохранения импульса и кинетической энергии. При этом происходит изменение кинетической энергии частиц, которое для бинарных процессов определяется выражением: 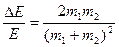 . Из данного соотношения следует, что при m1<<m2
. Из данного соотношения следует, что при m1<<m2 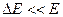 . Данный вывод справедлив при оценке особенностей упругих столкновений электронов с атомами или ионами. В таких системах упругие столкновения не оказывают существенного влияния на процессы передачи энергии.
. Данный вывод справедлив при оценке особенностей упругих столкновений электронов с атомами или ионами. В таких системах упругие столкновения не оказывают существенного влияния на процессы передачи энергии.
При неупругом столкновении происходит изменение внутренней энергии атомов. В этом случае 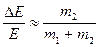 . Такого рода процессы получили название неупругих столкновений первого рода.
. Такого рода процессы получили название неупругих столкновений первого рода.
Неупругие столкновения второго рода – столкновения, которые протекают между электронами и возбужденными атомами, при которых электрон получает энергию за счет изменения внутренней энергии атомов.
Отметим, что внешние электрические и магнитные поля поляризуют плазму, увеличивая при этом вероятность актов столкновения.
Наиболее часто в плазме протекают процессы возбуждения атомов. Возбужденные атомы образуются, когда в результате столкновения электрон получает дополнительную энергию, и переходят на уровни с более высокой энергией. Возбуждение наблюдается в течение очень короткого промежутка времени (~10-8с). По истечении этого промежутка времени атом возвращается в основное состояние, испуская при этом квант энергии.
Процесс возбуждения наблюдается при взаимодействии атома с ионом: А+В+→А*+В+. При протекании таких реакций ион В+ передаёт часть своей энергии атому А.
Атомы могут переходить в возбужденное состояние и в результате его взаимодействия с электроном (электроностимулированное возбуждение, в том числе эффект электронного циклотронного резонанса (ЭЦР): А+е→А*+е. Причиной возбуждения атомов может быть и поглощение им электромагнитного излучения. Такой процесс называют фотовозбуждением. Он протекает по схеме А+hν→А*.
К числу наиболее вероятных механизмов возбуждения относят и взаимодействие атомов друг с другом, в результате которого атом В передает часть своей энергии атому А: А+В→А*+В. Если частота взаимодействий достаточно велика, то могут проходить процессы ступенчатого возбуждения, когда электрон последовательно переходит с одного энергетического возбужденного уровня на другие, более высокие.
Процесс возбуждения характеризуется следующими основными параметрами:
· эффективное сечение взаимодействия σвз;
· вероятность взаимодействия Рвз;
· длина свободного пробега λ;
· энергия возбуждения.
При высокой плотности заряженных частиц и большом числе столкновений атомов, ионов, электронов не исключена возможность одновременного перехода в возбужденное состояние нескольких электронов. При этом полная энергия возбуждения электронов может быть выше энергии ионизации атомов. В этом случае возможен переход электронов в основное состояние с излучением электромагнитных квантов. На основной уровень возвращается один из электронов, а второй получает дополнительную энергию и покидает атом. В результате образуется ион. Такой процесс носит название автоионизации.
В общем случае ионизация атомов является логическим продолжением процесса возбуждения. Процесс, как правило, протекает по схеме А→ А*→А++е, А+е→А-. Вероятность ионизации очень сильно зависит от энергии частиц, участвующих в процессе столкновения. В общем случае, эта зависимость имеет экстремальный характер. Как правило, наиболее эффективная ионизация имеет место при энергии электронов 20-100 эВ.
Процесс ионизация может происходить по различным механизмам:
1) в течение одного акта взаимодействия. В этом случае энергия, полученная атомом, должна быть больше (или равна) энергии ионизации 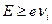 , где
, где 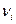 – потенциал ионизации атома;
– потенциал ионизации атома;
2) в результате ступенчатого возбуждения, последовательных переходов электронов на более высокие энергетические уровни. Частным случаем данного процесса является автоионизация.
Ступенчатое возбуждение имеет место, если частота столкновений, актов энергетического воздействия очень велика. Тогда электрон не успевает перейти на основной уровень, последовательно возбуждается и, в итоге, получает энергию, достаточную для ионизации атома.
Часто, при высокой плотности энергетического воздействия, процессы ионизации сопровождаются диссоциацией атомов. Такие процессы, как правило, протекают по схеме АВ→А++В-,АВ→А++В+е.
Как известно, в газовом разряде, в плазме генерируются интенсивное коротковолновое излучение. Если энергия кванта hν≥еvi (данному условию удовлетворяет электромагнитное излучение ультрафиолетового диапазона), то протекают процессы фотоионизации.
Анализ процессов, протекающих в плазме, показывает, что наиболее вероятна ударная ионизация. Это обстоятельство широко используется для повышения степени ионизации плазмы. Так, например, в плазму вводят атомы, которые легко ионизируются и, в свою очередь, способны вызвать ударную ионизацию других атомов, находящихся в газовой фазе.
Большой вклад в процессы генерации заряженных частиц вносят реакции ассоциативной ионизации. Они протекают в случае, когда энергия, полученная молекулой, мала и её разрушение не происходит: АВ → АВ++е. Достаточно часто происходят процессы диссоциативной ионизации АВ→А++В-, АВ→А++В++2е.
Наряду с процессами ионизации и возбуждения протекают и процессы, им обратные (процессы рекомбинации) А* → А + hν; А+ → А(А*). При рекомбинации сложных молекул возможна их диссоциация АВ++е → А+В.
Основной вклад в снижение степени ионизации вносит ионная рекомбинация, протекающая при столкновении противоположно заряженных частиц и сопровождающаяся снижением внутренней энергии плазмы. Избыток энергии может выделяться по следующим направлениям:
происходит передача энергии третьей частице С: А++В-+С→А+В+С*, А++В-+С→АВ+С*; или наблюдается испускание электромагнитного излучения А++В - → АВ+hν, или имеет место образование возбужденных частиц А++В- → А*+В*.
Вероятность проявления указанных выше процессов зависит от режимов и условий протекания газового разряда. Так, при высокой плотности плазмы (давление в зоне 10 Па и более) наиболее вероятен процесс рекомбинации вследствие передачи энергии третьей частице.
Значительное влияние на зарядовое состояние плазмы оказывают процессы ион-электронной рекомбинации А++е → А(А*)+hν, АВ++е → А*+В*. Генерируемые в плазме возбужденные и заряженные частицы способны взаимодействовать друг с другом и при определенных условиях образовывать химические соединения.
3.Формирование тонких слоев и покрытий из растворов (золь-гелевая технология).
К способам формирования тонких слоев и покрытий из растворовотносятся нанесения полимерных органических слоев и покрытий из растворов полимеров или преполимеров методами центрифугирования, окунания или распыления, которые были рассмотрены в разделе фотолитографии. Для формирование тонких неорганических слоев и покрытий из растворов аналогичными способами широко используется так называемая золь-гелевая технология. Эта технология очень близка к технологии получения органических полимеров по реакциям трехмерной полимеризации, поликонденсации или полиприсоединения полифункциональных мономеров или олигомеров и их смесей, которые подробно рассматриваются в курсах «Химия полимеров» и «Физика полимеров».
К золь-гелевой технологии относят большую группу методов получения (синтеза) неорганических стекловидных оксидных или керамических материалов, иногда рассматриваемых как неорганические полимеры. Наиболее известные варианты золь-гелевой технологии заключаются в контролируемом гидролизе и поликонденсации продуктов гидролиза в водных или водно-спиртовых растворах при заданной температуре и рН среды спиртовых производных (алкоголятов) гидроксидов металлов и переходных элементов, так называемых алкоксидов M(OR)x или хлоридов, реже нитридов этих элементов М(Cl)х и М(NO3)х соответственно, где M - атомы Si, Ti, Zr, V, Zn, Al, Sn, Ge, Mo, W и других элементов с последующим удалением (сушкой) или вытеснением растворителя и термообработкой (обжигом, спеканием) нерастворимых продуктов поликонденсации. Обязательными компонентами при этом являются также растворители (как правило, простые спирты: этанол, пропанол, изопропанол и др.), вода и кислоты (чаще всего минеральные – HCl, HNO3 и др.). Гидролиз и начальные стадии поликонденсации приводят к образованию золя – коллоидной дисперсии сетчатых (микрогелевых) частиц полигидроксидов, размер которых может лежать в пределах 10-1000 нм:
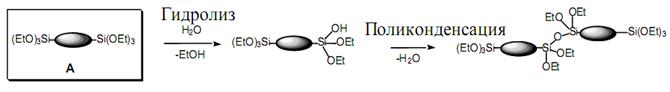
(RO)3 ΞSi – OR + HOH → (RO)3 Ξ Si – OH + ROH, или Ξ Si – OH + RO – Si Ξ →Ξ Si – O – SiΞ +ROH, или
Ξ Si – OH + HO – Si Ξ → ΞSi – O – Si Ξ + HOH.
На более глубоких стадиях поликонденсации образуется неорганический «мокрый» гель – непрерывная пространственная структура из соединенных ионно-ковалентными связями коллоидных частиц (остов геля) с заключенным (иммобилизованным) растворителем, также образующим непрерывную среду:
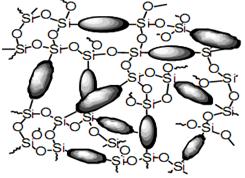
Согласно современным представлениям формирование геля вблизи критической точки (возникновения непрерывного остова) описывается теорией перколяции или протекания и геометрией фракталов.
Скорость и степень полноты протекания процессов образования золя и «мокрого» геля зависит от ряда химических и технологических факторов: а) природы и количества алкоксисоединения; б) количества воды; в) кислотности (рН) среды; г) природы и количества органических растворителей; д) приемов гомогенизации золь-гелевой системы; е) температуры и длительности процесса синтеза.
Важнейшую роль в золь-гелевой технологии играют процессы удаления растворителя из «мокрого» геля. В зависимости от метода их осуществления, могут быть получены различные продукты (ксерогели, амбигели, криогели, аэрогели), сохраняющие наноразмерные структурные элементов и высокие значения удельной поверхности (сотни м²/г) и служащие промежуточными продуктами (прекурсорами) при получении оксидных пленок, нанопорошков или керамики. Основные процессы и получаемые материалы в золь-гелвой технологии схематически показаны на рис. 2.17.
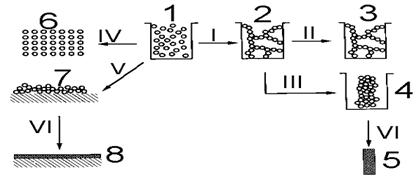
Рис. 2.17. Основные процессы и получаемые материалы в золь-гелевой технологии: I → превращение золя (1) после гидролиза и конденсации исходных продуктов (созревания) в «мокрый» гель (2); II → сушка геля в суперкритических условиях или промывание его вытесняющим воду растворителем с образованием аэрогеля (3); III → сушка геля в обычных условиях с образованием ксерогеля (4); IV→осаждение частиц золя с образованием нанопорошка (6); V → нанесение золя на подложки и формирование пленки ксерогеля (7); VI → обжиг ксерогеля (4) или пленки ксерогеля (7) и формирование монолитной керамики (5) или покрытия (8).
Формирование геля не останавливается в точке гелеобразования. В мокром геле единый кластер сосуществует с золем, который содержит множество мелких кластеров. В процессе выдержки во времени гель "стареет", в нем протекают процессы структурных изменений - присоединение мелких кластеров к общему остову - непрерывному кластеру. Кроме того, в гелях могут продолжаться реакции конденсации, не прошедшие до конца в золях. В процессе старения гелей обычно происходит усадка гелей, обусловленная деформацией сетки геля и удалением жидкости из пор. Высушенный гель называют ксерогелем. Ксерогель часто уменьшается в объеме в 5-10 раз по сравнению с объемом мокрого геля. Существуют специальные приемы, которые позволяют высушивать мокрый гель без изменения его структуры. Например, суперкритической сушкой при высоком давлении и низкой температуре получают аэрогель – сухой гель, в котором сохранился скелет мокрого геля, а поры взамен удаленной жидкой фазы заполнены воздухом. После высушивания ксерогели и аэрогели подвергают обжигу, в процессе которого формируется монолитный стеклообразный или керамический материал. Во время обжига происходит множество сложных физических и химических процессов, связанных с деструкцией органических фрагментов, встроенных в неорганическую сетку геля, удалением растворителей, летучих продуктов деструкции и химически связанной воды. Происходит перестройка структуры неорганического полимера – идет процесс спекания, а в ряде случаев и кристаллизация.
Наиболее часто в золь-гелевой технологии применяется этиловый эфир ортокремниевой кислоты, или сокращенно тетраэтоксисилан (ТЭОС). В предельном случае, если предположить, что реакция гидролиза ТЭОС идет до конца, ее можно выразить следующим образом: (C2H5O)4Si + 4H2O →H4SiO4 + 4C2H5OH. По мере протекания гидролиза ТЭОС равновесие сильно смещается вправо. Для сдвига равновесия влево и замедления скорости реакции гидролиз ТЭОС обычно осуществляют в присутствии этанола в кислой среде (pH < 7), хотя при этом процессы гидролиза ТЭОС не проходят до конца. Золи на основе ТЭОС, гидролизуемого в кислой среде, могут быть допированы (легированы) алкоксидами или солями металов, что придает получаемым силикатам необходимые свойства – каталитические, электрические и др.
Среди первых объектов, изготавливаемых золь-гелевым методом еще с 60-х гг. прошлого века в микроэлектронике в качестве источников легирующих примесей – допантов, были стекловидные нанотолщинные пленки. В настоящее время в планарной технологии микроэлектроники и микросистемной техники такие пленки используются как маскирующие, изолирующие, планаризирующие, жертвенные и геттерные покрытия, а также в качестве металлоксидных чувствительных элементов различных сенсоров, в том числе, болометров. Наноразмерные пленки толщиной 30-200 нм получают из золей методом центрифугирования, поэтому в зарубежной литературе часто их называют "spin-on glass"-пленками.
Золь-гелевая технология получения стекловидных пленок имеет ряд существенных достоинств, позволяя проводить многие технологические процессы в регулируемых условиях при температуре 250-450 °С. Однако для обеспечения требуемых свойств таких пленок - равномерности по толщине, целостности или сплошности (отсутствия разрывов и трещин), гомогенности по структуре (отсутствия расслоений и кристаллических включений), способности удаляться в селективных травителях или методами «сухого» травления без нарушения нижележащих слоев, не говоря уже об их функциональных свойствах, необходимо разрабатывать оптимальные составы золей, подбирать оптимальные условия нанесения пленок на подложки и оптимальные режимы термообработок. Сделать это при многоэтапности циклов получения наноразмерных пленок из неустойчивых во времени золей (синтез и созревание золей, формирование пленок на подложке, гелеобразование, сушка и отжиг с переходом элементорганических мономеров в неорганические полимеры и оксидные слои) многообразии и сложности протекающих при этом физико-химических процессов, достаточно сложно. Каждый из этих этапов оказывает существенное влияние на свойства формируемых пленок, поэтому добиться воспроизводимости свойств и качества пленок чрезвычайно трудно.
Поиск по сайту: