 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекция 8. Диссоциация оксидов в системах с растворами. Окислительное рафинирование. Раскисление. Металлотермия
Определим закономерность  оксида, диссоциирующего в системе из двух несмешивающихся жидких растворов: металлического и оксидного: 2 [Me] + O2 = 2 (MeO). Квадратными скобками [Ме] обозначаем металл, растворенный в металлической фазе, а круглыми скобками (МеО) – оксид, растворенный в оксидной фазе. В уравнениях константы равновесия, квадратными скобками [Ме] обозначим концентрацию раствора металла в металлическом растворителе, круглыми скобками (МеО) концентрацию раствора оксида металла в оксидной фазе (концентрации в молярных долях).
оксида, диссоциирующего в системе из двух несмешивающихся жидких растворов: металлического и оксидного: 2 [Me] + O2 = 2 (MeO). Квадратными скобками [Ме] обозначаем металл, растворенный в металлической фазе, а круглыми скобками (МеО) – оксид, растворенный в оксидной фазе. В уравнениях константы равновесия, квадратными скобками [Ме] обозначим концентрацию раствора металла в металлическом растворителе, круглыми скобками (МеО) концентрацию раствора оксида металла в оксидной фазе (концентрации в молярных долях).
Установим зависимость  от концентраций металла [Ме] и оксида (МеО) (рис. 8, 9). Для решения поставленной задачи используем выражение константы диссоциации:
от концентраций металла [Ме] и оксида (МеО) (рис. 8, 9). Для решения поставленной задачи используем выражение константы диссоциации:  .
.

|

|
В системе присутствуют две конденсированные фазы: раствор металла и раствор оксида, развивающие давление паров металла 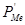 и паров оксида
и паров оксида  .
. 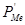 и
и  зависящие только от состава соответствующих растворов. Подставляя эти значения парциальных давлений металла и оксида в уравнение, получим выражение константы диссоциации оксида:
зависящие только от состава соответствующих растворов. Подставляя эти значения парциальных давлений металла и оксида в уравнение, получим выражение константы диссоциации оксида:  с единственной переменной - парциальным давлением кислорода. Для определения парциальных давлений паров металла
с единственной переменной - парциальным давлением кислорода. Для определения парциальных давлений паров металла  и паров оксида
и паров оксида  , используем закон Генри, согласно которому молярная доля вещества в растворе пропорциональна равновесному давлению его паров над раствором. Применяя закон Генри к растворам металла и оксида, получим соотношение:
, используем закон Генри, согласно которому молярная доля вещества в растворе пропорциональна равновесному давлению его паров над раствором. Применяя закон Генри к растворам металла и оксида, получим соотношение: 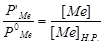 ,
,  ,
,  и
и  .
.
Подставим 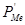 и
и  ), получим:
), получим:  , в котором
, в котором  - константа диссоциации, соответствующая равновесию реакции: 2Ме(конд) + О2 = 2 МеО(конд) с участием двух чистых конденсированных веществ: металла и оксида.
- константа диссоциации, соответствующая равновесию реакции: 2Ме(конд) + О2 = 2 МеО(конд) с участием двух чистых конденсированных веществ: металла и оксида.
Вводя К0 получим:  . Уравнение дает точные результаты, если растворы металла и раствор оксида подчиняются законам идеальных растворов.
. Уравнение дает точные результаты, если растворы металла и раствор оксида подчиняются законам идеальных растворов.
Изучение закономерности диссоциации оксида в растворе приводит к следующему:
1) Растворенный оксид имеет меньшую упругость диссоциации, чем свободной оксид.
2) Давление кислорода при диссоциации оксида уменьшается с уменьшением его концентрации в растворе неограниченно.
3) Повышение концентрации оксида в растворе до насыщения увеличивает давление кислорода до максимального значения, равного давлению кислорода при диссоциации свободного нерастворимого оксида.
4) Переход металла в раствор увеличивает упругость диссоциации оксида.
5) С уменьшением концентрации металла в растворе упругость диссоциации оксида возрастает неограниченно.
6) Увеличение концентрации металла в растворе снижает упругость диссоциации оксида до нижнего предела ее значения (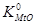 ).
).
7) С увеличением концентрации МеО в шлаке от 0 до 1  увеличивается от 0 до К0. При уменьшении концентрации Ме от 1 до 0
увеличивается от 0 до К0. При уменьшении концентрации Ме от 1 до 0  возрастает от К0 до бесконечно большого.
возрастает от К0 до бесконечно большого.
Теория окислительного рафинирования металлов. Окислительному рафинированию подвергают загрязненный черновой металл, полученный выплавкой из рудного сырья. Степень загрязненности чернового металла колеблется в широких пределах от долей % до 10%. Черновая медь содержит 1-2 % примесей: (Fe, Pb, Mn, Zn, S, Ni, As, Si, Bi, Ag, Au и пр.), чугун – 5-8% примесей (C, Si, Mn, P, S и пр.), веркблей до 10% (Sb, As, Sn, Bi, Cu, Ag, Au). Окислительное рафинирование заключается в частичном окислении компонентов расплава, имеющих большее сродство к кислороду, чем у основного металла, чем достигается перевод примесей в оксиды. Оксиды затем выводятся в шлак или улетучиваются.
Однако, для успеха окислительного рафинирования одной разницы в упругостях диссоциации недостаточно. Окислившаяся примесь в ряде случаев все же остается в расплаве рафинируемого металла или из-за растворимости оксидов в металлической ванне, или из-за образования между оксидами примесей и оксидами рафинируемого металла соединений, растворимых в ванне; и малой разницей в плотностях оксида примеси и рафинируемого металла.
Введенный в расплав кислород усваивается, т.е. переходит в оксиды, и затем между оксидами рафинируемого металла (Ме) и оксидами примесей (Ме’, Me’’, Me’’’) устанавливаются сопряженные равновесия: МеО + Me’ = Me’O + Me; MeO + Me’’ = Me’’O + Me; MeO + Me’’’ = Me’’’O + Me. Такая равновесная система состоит из одной жидкой металлической фазы – сплава металлов Ме’, Me’’, Me’’’ с небольшим количеством растворенных оксидов; фазы, составленной оксидами и газовой фазы, если в процессе образуются газообразные оксиды. Описываемое равновесие можно рассматривать как равновесие распределения малого (недостаточного для полного окисления металлов) количества кислорода между металлами Ме, Ме’, Me’’, Me’’’. Условием такого равновесия будет равенство давлений кислорода, развивающихся при диссоциации каждого из сосуществующих оксидов.
При воздействии кислорода на расплавленный загрязненный металл большая часть кислорода свяжется с основным металлом, т.к. он составляет подавляющую часть металлического расплава. Затем оксид основного металла передаст кислород растворенным примесям: МеО + Me’ = Ме + Me’O. Если рафинируемый металл значительно растворяет свой оксид, то реакции рафинирования смогут осуществляться во всей массе металлической ванны. Такими свойствами обладают жидкие медь, железо и никель. Растворимость оксидов примесей в металлической ванне представляет собой конечную величину, очень малую в сравнении с количеством содержащейся примеси, так что окисление самой небольшой доли примеси будет насыщать ванну ее оксидом. Окисление примеси должно описываться уравнением: 2 [Me’] + O2 = 2 Me’O. Упругость диссоциации оксида примеси при рафинировании описывается уравнением: 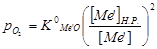 , где
, где  – константа диссоциации оксида примеси Me’O; [ Me’ ] Н..Р . – растворимость Me’ в расплавленном основном металле при температуре процесса; [ Me’ ] – концентрации Me’ в основном расплавленном металле.
– константа диссоциации оксида примеси Me’O; [ Me’ ] Н..Р . – растворимость Me’ в расплавленном основном металле при температуре процесса; [ Me’ ] – концентрации Me’ в основном расплавленном металле.
Давление диссоциации МеО, выражается уравнением: 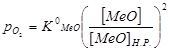 , где:
, где:  – константа диссоциации оксида; [ MeО ] Н..Р. – растворимость оксида основного металла в основном металле при температуре рафинирования; [ MeО ] – концентрация МеО в металлической ванне.
– константа диссоциации оксида; [ MeО ] Н..Р. – растворимость оксида основного металла в основном металле при температуре рафинирования; [ MeО ] – концентрация МеО в металлической ванне.
В начале процесса рафинирования концентрация оксида основного металла высокая, а упругость его диссоциации и способность отдавать свой кислород примесям высокая. Наибольшей упругости диссоциации, т.е. наибольшей способности окислять примеси МеО приобретает в момент насыщения им ванны, когда его концентрация достигает значения [ МеО ] Н.Р.
Примем концентрацию примесей в ванне до начала - [ Me’ ] нач, [ Me’’ ] нач, [Me’’’]нач, а упругость диссоциации их оксидов:  ,
,  ,
,  . При протекании процесса концентрация основного металла [ Ме ] практически не меняется, так как его обычно более 95-99 %, концентрация (МеО) и примесей уменьшается, а концентрация оксидов примесей возрастает. Это приводит к повышению упругости диссоциации оксидов примесей и снижению упругости диссоциации оксида основного металла. В конце рафинирования упругости диссоциации оксидов всех удалявшихся примесей станут равными максимальному значению упругости диссоциации окислителя МеО – величине КоМеО ., чему соответствуют конечные концентрации примесей в металлической ванне [ Ме ] кон., определяемые по уравнению:
. При протекании процесса концентрация основного металла [ Ме ] практически не меняется, так как его обычно более 95-99 %, концентрация (МеО) и примесей уменьшается, а концентрация оксидов примесей возрастает. Это приводит к повышению упругости диссоциации оксидов примесей и снижению упругости диссоциации оксида основного металла. В конце рафинирования упругости диссоциации оксидов всех удалявшихся примесей станут равными максимальному значению упругости диссоциации окислителя МеО – величине КоМеО ., чему соответствуют конечные концентрации примесей в металлической ванне [ Ме ] кон., определяемые по уравнению: 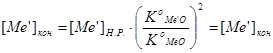
Дальнейшее снижение [ Me’ ]кон в заданных условиях рафинирования невозможно.
Т. о., при рафинировании будут удаляться только примеси, имеющие бόльшее сродство к кислороду, чем основной металл. Конечное содержание примеси определяется величинами КоМеО и КоМе’О, не зависит от [ Me’ ] нач и тем меньше, чем у примеси больше сродство к кислороду.
Роль шлака в процессах окислительного рафинирования металлов. Металл и покрывающий его шлак обменивается растворенными оксидами металлов. В условиях равновесия концентрации оксида в металлической и шлаковой фазе пропорциональны растворимостям в соответствующих фазах (Закон распределения). В равновесии активности оксида в обеих фазах одинаковы. Для идеальных растворов активности пропорциональны концентрациям: 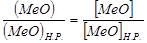 или
или  .
.
Упругость диссоциации оксида примеси Me’O будет выражаться формулой:  , из которой вытекает, что чем меньше концентрация оксида примеси в шлаке, тем меньше упругость диссоциации оксида. Таким образом, шлак, растворяя оксиды примеси, понижает упругость их диссоциации, что облегчает окисление примеси, но, одновременно, шлак, растворяя оксид основного металла, понижает упругость его диссоциации, и этим снижается способность данного оксида отдавать кислород примесям.
, из которой вытекает, что чем меньше концентрация оксида примеси в шлаке, тем меньше упругость диссоциации оксида. Таким образом, шлак, растворяя оксиды примеси, понижает упругость их диссоциации, что облегчает окисление примеси, но, одновременно, шлак, растворяя оксид основного металла, понижает упругость его диссоциации, и этим снижается способность данного оксида отдавать кислород примесям.
 .
.
Решая это уравнение относительно конечной концентрации примеси, получим:
 .
.
Сравнивая это выражение с выражением для работы без шлака:  , приходим к выводу, что роль шлака определяется «шлаковым множителем» в правой части формулы:
, приходим к выводу, что роль шлака определяется «шлаковым множителем» в правой части формулы:  . Повышение концентрации оксида рафинируемого металла и уменьшение концентрации оксида примеси в шлаке благоприятствует более полному удалению примеси. Большое влияние на результат рафинирования может оказать введение в шлак флюса, химически активного по отношению к одному из оксидов: оксиду примеси или к оксиду рафинируемого металла. Этим приемом пользуются в практике рафинирования железа от фосфора, свинца от олова, мышьяка и сурьмы, применяя основные флюсы, связывающие кислотные оксиды этих примесей в прочные соединения. Такой прием применим в случаях, когда основной металл и примесь сильно различаются по химическим свойствам. Если оба оксида основания или кислоты, то найти подходящую добавку нельзя и такой прием делается малоэффективным, так как может быть использована только разница в кислых и основных свойствах, в большинстве случаев небольшое.
. Повышение концентрации оксида рафинируемого металла и уменьшение концентрации оксида примеси в шлаке благоприятствует более полному удалению примеси. Большое влияние на результат рафинирования может оказать введение в шлак флюса, химически активного по отношению к одному из оксидов: оксиду примеси или к оксиду рафинируемого металла. Этим приемом пользуются в практике рафинирования железа от фосфора, свинца от олова, мышьяка и сурьмы, применяя основные флюсы, связывающие кислотные оксиды этих примесей в прочные соединения. Такой прием применим в случаях, когда основной металл и примесь сильно различаются по химическим свойствам. Если оба оксида основания или кислоты, то найти подходящую добавку нельзя и такой прием делается малоэффективным, так как может быть использована только разница в кислых и основных свойствах, в большинстве случаев небольшое.
Окислительное огневое рафинирование черновой меди, железа.
Раскислениея металлов. По завершении процесса удаление примесей при окислительном рафинировании расплавленный металл насыщен своим оксидом. Такой металл непригоден для использования и должен быть освобожден от кислорода – раскислен. Процесс раскисления заключается в восстановлении растворенного оксида раскислителем с образованием нерастворимого оксида раскислителя, всплывающего на поверхность жидкого металла: [MeO] + [R] = [Me] + (RO).
Раскислителем служит вещество с бόльшим сродством к кислороду. Реакция раскисления закончится как только будут равными упругости диссоциации обоих оксидов, т.е. когда:  =
=  . Откуда получаем, что остаточная концентрация оксида металла будет равна:
. Откуда получаем, что остаточная концентрация оксида металла будет равна:  . Анализ уравнения позволяет сделать вывод, что для обеспечения низкой концентрации растворенного оксида основного металла в ванне должен оставаться определенный избыток раскислителя; и этот избыток тем меньше, чем меньше величина KoRO. Раскислители, кроме доступности и дешевизны, должны иметь много больше сродства к кислороду, чем раскисляемый металл; быстро растворяться в раскисляемом металле; не давать газообразных продуктов раскисления; остаток раскислителя в готовом металле не должен ухудшать качества этого металла; оксид раскислителя должен быть мало растворим раскисляемом металле и легко отделяться от него.
. Анализ уравнения позволяет сделать вывод, что для обеспечения низкой концентрации растворенного оксида основного металла в ванне должен оставаться определенный избыток раскислителя; и этот избыток тем меньше, чем меньше величина KoRO. Раскислители, кроме доступности и дешевизны, должны иметь много больше сродства к кислороду, чем раскисляемый металл; быстро растворяться в раскисляемом металле; не давать газообразных продуктов раскисления; остаток раскислителя в готовом металле не должен ухудшать качества этого металла; оксид раскислителя должен быть мало растворим раскисляемом металле и легко отделяться от него.
Металлотермия. Металлотермическими называются процессы восстановления металлов из оксидов при помощи других металлов по реакции: MeO + Me’ = Me + Me’O + Q.
Теория металлотермических процессов основана на тех же самых представления, что и процессы окислительного рафинирования и раскисления. В процессе реагирования MeO и Me’ образуются Me и Me’O. При расплавлении шихты металлы образуют сплав, оксиды – шлак, причем дальнейшее реагирование протекает между двумя реагирующими фазами: (MeO) + [Me’] = (Me’O) + [Me]
На практике широко применяется алюмотермия:
Cr2O3 + 2Al = Al2O3 + 2Cr + 526,18 кДж
3MnO + 2 Al = Al2O3 + 2Mn + 517,39 кДж
3V2O5 + 10 Al = 5Al2O3 + 6 V
и силикотермия:
2V2O5 +5 Si + 5CaO = 4V + 5CaSiO3
2MoO2 + Mo2Si8 + 3CaO = 5Mo + 3CaSiO3
3MoO2 + 2CaO = 3Mo + 2CaSiO3 + 2CO
MoO2 + FexSi + CaO = Mo + xFe + CaO*SiO2
Лекция 9. Сродство углерода к О2. Восстановление оксидов металлов
Закономерность изменения сродства углерода к кислороду
Окисление углерода используют как для энергетических, так и для химических целей. Рассмотрим основные реакции горения углерода
1.  - реакция полного горения углерода.
- реакция полного горения углерода.
2.  - реакция неполного горения углерода.
- реакция неполного горения углерода.
3.  - реакция догорания
- реакция догорания  ;
;  .
.
4.  - реакция восстановления углекислого газа при помощи С;
- реакция восстановления углекислого газа при помощи С;  .
.
Реакции 1 и 2 термодинамически необратимы.
Рассмотрим термодинамически обратимые реакции 3 и 4.
4.  - Реакция Белла-Будуара.
- Реакция Белла-Будуара.
Реакция протекает слева направо с поглощением тепла и с увеличением объема системы. Равновесная газовая фаза обогащается оксидом углерода при повышении температуры и обедняется ею с ростом давления. Константа равновесия этой реакции  , где
, где 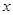 - концентрация
- концентрация  в смеси
в смеси  , считая их сумму за 1;
, считая их сумму за 1;  - общее давление
- общее давление  .
.


Зная  и Робщ можно вычислить состав равновесной газовой смеси. Константа равновесия реакции газификации углерода может быть рассчитана по формуле Фальке:
и Робщ можно вычислить состав равновесной газовой смеси. Константа равновесия реакции газификации углерода может быть рассчитана по формуле Фальке:
 .
.
Численные значения констант равновесия равны:
| Т | ||||||

| -2,05 | -0,78 | +0,22 | +1,04 | +1,73 | +2,30 |
3. 
По правилу фаз в состоянии равновесия данная однофазная двухкомпонентная ( ) система при (
) система при ( ) имеет 3 степени свободы:
) имеет 3 степени свободы: 
Уравнение константы равновесия -  .
.
Влияние температуры и давления. На основании принципа Ле-Шателье при повышении температуры (при постоянном давлении) равновесие сместится в сторону с эндотермическим эффектом, т. е. пойдёт диссоциация 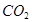 на
на  и
и 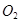 . Повышение давления при постоянной температуре вызовет процесс, сопровождающийся уменьшением объема системы. В данном случае это будет реакция образования
. Повышение давления при постоянной температуре вызовет процесс, сопровождающийся уменьшением объема системы. В данном случае это будет реакция образования 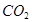 из
из  и
и 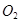 . Константа равновесия реакции диссоциации может быть вычислена по формуле Чипмена и Самарина:
. Константа равновесия реакции диссоциации может быть вычислена по формуле Чипмена и Самарина: 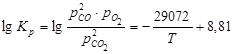 .
.
Кр может быть рассчитана по уравнению Нернста:  .
.
Определив константу равновесия реакции можно определить степень диссоциации 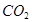 , состав газовой фазы. Зная константу равновесия можно определить и
, состав газовой фазы. Зная константу равновесия можно определить и 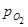 в зависимости от соотношения
в зависимости от соотношения
 и
и 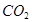 :
:  ;
; 
Величины Кр диссоциации  , свидетельствуют о большой прочности
, свидетельствуют о большой прочности 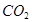 .
.

| |||||

| -49,93 | -27,81 | -20,43 | -10,60 | -5,73 |
На основании закона Гесса можно определить термодинамические характеристики двух необратимых реакций (1 и 2) суммируя две термодинамически обратимые реакции (3 и 4).
Если сложить реакцию 3 и реакцию 4, получим реакцию полного горения. Если сложить реакцию 3 и две реакции 4, получим в сумме реакцию 2. Тогда  , а
, а  (рисунок 3). Сродство углерода к кислороду по реакции полного горения практически не зависит от температуры, по реакции неполного горения сродство углерода к кислороду возрастает с повышением температуры. По реакции догорания сродство СО к кислороду при повышении температуры уменьшается..
(рисунок 3). Сродство углерода к кислороду по реакции полного горения практически не зависит от температуры, по реакции неполного горения сродство углерода к кислороду возрастает с повышением температуры. По реакции догорания сродство СО к кислороду при повышении температуры уменьшается.. 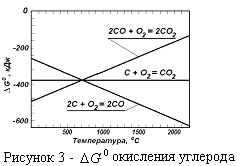
Восстановление оксидов металлов при помощи СО. Восстановление оксидов металлов при помощи СО описывается уравнением: МеО+СО=Ме+СО2–ΔH.
Константа равновесия при (МеО)=1 и [Me]=1 равна:  . Отсюда, равновесный состав газовой фазы равен:
. Отсюда, равновесный состав газовой фазы равен:  .
.
Реакция может быть экзотермическая или эндотермическая:
PbO+CO=Pb+CO2 – 69.4 кДж,
0.5SiO2+CO=Si+CO2+155.5 кДж.


Для экзотермических реакций при повышении температуры равновесный состав газовой фазы обогащается по СО, для эндотермических – по СО2.
На рисунках 4 и 5 приведены равновесные составы газовой фазы реакций восстановления в зависимости от температуры, совмещённые с кривыми равновесия реакции Будуара. Равновесный состав газовой фазы, обеспечивающийся реакцией Будуара будет являться составом газовой фазы в системе С-О с избытком углерода. 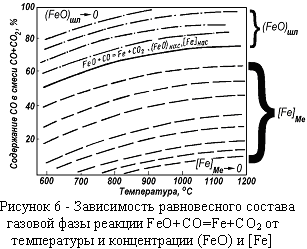 В нижней части диаграмм расположены металлы с малым сродством к кислороду (Cu, Pb, Ni) для восстановления которых достаточно небольших давлений СО в газовой фазе. В верхней части диаграмм – металлы с большим сродством к кислороду. Восстановление возможно, когда давление СО в газовой фазе превышает равновесное давление СО для восстановления конкретного оксида. Например, при давлении газовой фазы в одну атмосферу восстановление Fe3O4 до FeO будет происходить при температуре выше 640 ºС, а восстановление FeO до Fe –при температуре выше 690 ºС (рисунок 4).
В нижней части диаграмм расположены металлы с малым сродством к кислороду (Cu, Pb, Ni) для восстановления которых достаточно небольших давлений СО в газовой фазе. В верхней части диаграмм – металлы с большим сродством к кислороду. Восстановление возможно, когда давление СО в газовой фазе превышает равновесное давление СО для восстановления конкретного оксида. Например, при давлении газовой фазы в одну атмосферу восстановление Fe3O4 до FeO будет происходить при температуре выше 640 ºС, а восстановление FeO до Fe –при температуре выше 690 ºС (рисунок 4).
Реакция восстановления с участием расплавов: (МеО) +СО= [ Ме ] +СО2–ΔH. Константа равновесия  , а равновесный состав газовой фазы
, а равновесный состав газовой фазы  . Из уравнения следует, что
. Из уравнения следует, что 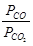 зависит от концентрации металла - [ Ме ] и концентрации оксида (МеО) в расплавах.При уменьшении содержания (FeO) в расплаве равновесное содержание СО возрастает (рисунок 6), стремясь в пределе к 100%.
зависит от концентрации металла - [ Ме ] и концентрации оксида (МеО) в расплавах.При уменьшении содержания (FeO) в расплаве равновесное содержание СО возрастает (рисунок 6), стремясь в пределе к 100%.
При уменьшении содержания [Fe] равновесное содержание СО снижается, стремясь в пределе к 0%. Так как в газовой фазе при любых температурах присутствует и СО и СО2, невозможно восстановить нацело оксид, находящийся в расплаве, и из смеси оксидов восстановить селективно только один металл – все присутствующие в расплаве оксиды будут восстанавливаться в равновесных количествах.
Углетермическое восстановление. Восстановление оксидов металлов твердым углеродом можно представить уравнением: MeO + С = Me + СО. ΔG0 = ΔG0CO -ΔG0MeO
В реальных условиях в большинстве случаев процесс усложняется. Углерод растворяется во многих металлах (Fe, Mn, Cr, W и др.), что приводит к образованию карбидов и изменяет величину ΔG° и температуры равновесия реакции.
Углеродотермическое восстановление оксидов (в доменной или электрической печах) обычно протекает при сравнительно высоких температурах и продуктом восстановления будет либо карбид, либо металл, насыщенный углеродом при данной температуре. Карбиды обладают важными свойствами, используемыми в промышленности, например, карбиды хрома имеют высокую твердость и прочность на истирание и используются для наплавки поверхностей, подвергающихся истиранию (конуса доменных печей, сельскохозяйственная техника и др.). Карбид кремния (карборунд) имеет высокую твердость, стойкость к воздействию высоких температур, высокую электрическую проводимость. Эти качества используют при изготовлении нагревательных элементов, специальных огнеупоров и абразивных материалов. Карбиды кальция и алюминия - сильные восстановители. Реакции образования карбидов кальция, кремния и алюминия имеют вид:
СаО + ЗС = СаС2 + СО; ΔG0 = 433 836 — 192.2Т Дж
SiO2 + ЗС = SiC + 2CO; ΔG0 = 526 573 — 344,2Г Дж;
2/8А12О3 + ЗС = 1/3Al2C3 + 2CO; ΔG0 = 804 703 — 321, 5Г Дж.
Для этих реакций температуры, при которых ΔG0 = 0, соответственно равны 2257, 1530, 2503 К.
Если температура восстановления оксидов выше, чем температура кипения металла, то процесс опишется уравнением: МеОТ + С = MeП + CO. Для этой реакции  .
.
При восстановлении оксида цинка твердым углеродом в зависимости от условий процесса образуется СО или СО2: ZnOT + С ↔ ZnП + CO2 ( ); 2ZnOT + C↔2ZnП + CO2 (
); 2ZnOT + C↔2ZnП + CO2 ( ).
).
Равновесный состав газовой фазы можно определить в предположении, что в системе протекают независимые реакции: ZnOT + СО = 2ZnП + СО2 ( ); ΔG° = 334 609 — 439,ЗT + 67,36Т lg Т Дж;
); ΔG° = 334 609 — 439,ЗT + 67,36Т lg Т Дж;
С+СО2 ↔ 2СО; ΔG°=170821-174,58Т Дж ( ); ZnT↔ZnП; ΔG° = 131214-181, 28Т+24.03Тlg Т Дж.
); ZnT↔ZnП; ΔG° = 131214-181, 28Т+24.03Тlg Т Дж.
Используя уравнение баланса массы  , уравнения константы равновесия
, уравнения константы равновесия  и
и  , получим уравнение для определения
, получим уравнение для определения  :
:  .
.
При повышенных температурах может происходить восстановление оксидов углеродом, растворенным в металле (оксиды, как правило, в этом случае находятся в растворе). Такой вид восстановления имеет место, например, в горне доменной печи, где восстановление FeO из оксидного расплава осуществляется углеродом, растворенным в чугуне. В этом случае процесс восстановления описывается уравнением: [С] + (МеО) = [ Me ] + СО.
Точность расчетов подобных процессов в значительной степени зависит от точности определения активности оксида в расплаве и активности углерода, растворенного в металле. Иногда в качестве восстановителя выступает углерод, находящийся в соединении, например, карбид. Реакция восстановления может быть представлена в общем виде: МеО + Ме'С = Me' + Me + CO, и выражение для константы равновесия может быть различным в зависимости от состояния веществ, участвующих в процессе.
 Восстановление волородом. В качестве газов-восстановителей используют водород, оксид углерода, их смеси, углеводороды. Углеводороды предварительно подвергают конверсии для предотвращения при восстановлении выделения углерода и науглероживания металла. Если для восстановления используется водород, то анализ термодинамической возможности восстановления оксидов может быть проведен с помощью диаграммы ΔG° = f (Т) для реакций образования оксидов металлов и водяного пара. Процесс восстановления можно представить уравнением: МеОК + Н2 = = МеК + Н2О, где МеОк и Me — конденсированные фазы оксида и металла. Состав газовой фазы состоящей из Н2 и Н2О, равновесной с твердыми фазами, определяется путем решения двух уравнений:
Восстановление волородом. В качестве газов-восстановителей используют водород, оксид углерода, их смеси, углеводороды. Углеводороды предварительно подвергают конверсии для предотвращения при восстановлении выделения углерода и науглероживания металла. Если для восстановления используется водород, то анализ термодинамической возможности восстановления оксидов может быть проведен с помощью диаграммы ΔG° = f (Т) для реакций образования оксидов металлов и водяного пара. Процесс восстановления можно представить уравнением: МеОК + Н2 = = МеК + Н2О, где МеОк и Me — конденсированные фазы оксида и металла. Состав газовой фазы состоящей из Н2 и Н2О, равновесной с твердыми фазами, определяется путем решения двух уравнений:  ;
;  .
.
Некоторые металлы, такие как железо, марганец, вольфрам, молибден и другие образуют несколько оксидов. Восстановление в этом случае протекает в две или более стадий.
Для оксидов железа при температурах выше 810 К восстановление протекает по трехстадийной схеме:
ЗFе2О3 (т) + Н2 (СО)= 2Fе3O4 (т) + Н2O (СО2);
2Fе3O4 (т) + 2Н2 (СО)= 6FeOт + 2Н2О (СО2);
6FeOт + 6Н2 = 6Fет + 6Н2О (СО2).
При температурах ниже 840 К Ре3О4 восстанавливается сразу до железа, поэтому процесс восстановления Fе2О3 становится двухстадийным:
ЗFе2О3 (т) + Н2 (СО) = 2Fе3O4 (т) + Н2O (СО2);
2Fе3O4 (т) + 8Н2 (СО) = 6Ре + 8Н2О (СО2).
Используя рисунок 1, можно при заданной температуре, общем давлении и парциальном давлении одного из газов определить область существования конденсированной фазы (железа, вюстита, магнетита или гематита).
Равновесные характеристики восстановления других оксидов могут быть определены подобным образом. Восстановление оксидов никеля и кобальта возможно при 1000 К уже при содержании диоксида углерода в газовой фазе ниже 99,7 %. Восстановление же WO3 водородом возможно только при содержании влаги не более 0,01 %, т. е. осушенным водородом.
Сопоставление линий равновесного состава газовой фазы при восстановлении оксидов железа газами СО и Н2 (рисунок 7) показывает, что при температурах Т < 1083 К для восстановления оксидов железа требуется более высокое по сравнению с СО парциальное давление Н2 в газовой фазе. При Т > 1083 К соотношение обратное: для соответствующих оксидов равновесное парциальное давление Н2 ниже, чем равновесное парциальное давление СО.
Таким образом, при Т < 1083 К более сильным восстановителем является оксид углерода, а при Т > 1083 К - водород. Это изменение восстановительной способности СО и Н2 иллюстрируется рисунке 7 (пересечение линий равновесного состава смесей СО—СО2 и Н2—Н,О).
Плазменное восстановление. При помощи плазмы удается восстановить очень прочные оксиды, такие как WO3, TiO2, SiO2) FeO, разложить природные соединения ZrSiO4, FeTiO3, ЗВеО·Al2O3·6SiO2, восстановить галогены ВеС13, NbCl3 при помощи водорода, провести рафинирование металлов и т.д. Характерные особенности плазменного состояния вещества следующие. Первая - в этом состоянии атомы вещества полностью или в значительной степени ионизированы. Вторая - температура самой плазмы достигает величин от тысяч градусов до нескольких десятков тысяч градусов Кельвина. В металлургии и вообще в технике используется так называемая низкотемпературная плазма 3000—15000 К (высокотемпературная плазма - Т >15000 К).
Плазма создается в специальных устройствах, называемых плазмотронами. Принцип действия плазмотрона основан на том, что газ, называемый плазмообразующим, пропускают через область горения дугового разряда, при этом он нагревается до нескольких тысяч градусов, частично ионизируется и превращается в плазму. Газ при нормальных условиях является типичным диэлектриком, однако, если в таком диэлектрике появится достаточно мощное электрическое поле, часть молекул газа может ионизироваться: Г = Г+ + ē, а заряженные частицы (ионы Г+ и электроны ē) под действием разности потенциалов на электродах образуют направленное движение и в газе возникнет электрический ток. Под действием электрического поля заряженные частицы движутся с ускорением, значит, они будут наращивать свою энергию и при столкновении с нейтральными атомами эту энергию отдавать. Если энергия поля окажется достаточно большой, то носители заряда начнут размножаться, выбивая электроны из атомов. Начнется то, что называют лавинообразной ионизацией. Поэтому газ, прошедший сквозь дугу, сильно ионизирован и нагрет до высоких температур.
Главным отличием плазменного восстановления от обычных восстановительных процессов является более высокая температура системы. Струя плазмы с температурой 3000—6000 К нагревает материалы до 2000—5000 К. Высокая температура в традиционных металлургических процессах обусловливает хорошую жидкотекучесть (малую вязкость) расплавов. Для достижения этой цели достаточно иметь в печах температуру 1200—1800 К. В плазмотермических печах роль температуры иная.
Существуют очень прочные оксиды (например, WO3, Al2O3, TiO2 и т.п.), которые при обычных температурах металлургических процессов не могут ни диссоциировать, ни восстанавливаться углеродом (рисунок 2). Однако с ростом температуры сродство этих металлов к кислороду, а значит, и прочность оксидов уменьшаются, а сродство углерода к кислороду растет. При высоких температурах эти прочные оксиды можно восстановить по реакции: Ме+ С = Me + СО2.
Зависимость свободной энергии для ряда подобных реакций от температуры следующая:
2WO3 + ЗС = 2W + СО2; ΔG° = 114,93 - 117,71 Т;
TiO + С = Ti + CO2; ΔG° = 49,51 - 0,17 Т;
SiO2 + С = Si + СО2; ΔG°= 122,31 - 42,13 Т;
2А12О3 + ЗС = 4А1 + ЗСО2; ΔG° = 523,05 - 156,61 Т.
Поиск по сайту: