 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Электролиз расплава NaОН на инертных электродах
|
Читайте также: |
Ионный состав расплава: NaOH → Na+ + OH- (сильный электролит)
Электроды: графит Ств или Pt – не участвуют в реакциях (инертные)
 К: Na+ + e → Na0 |4 только один процесс
К: Na+ + e → Na0 |4 только один процесс
 А: 4OH- → O2↑ + 2H2O + 4 e только один процесс
А: 4OH- → O2↑ + 2H2O + 4 e только один процесс
4Na++ 4OH- = 4Na0 + O2↑ + 2H2O
По закону Фарадея 
m -масса полученного на катоде натрия; Вi - выход по току
Выходом по току i- го вещества (Вi) называется доля общего
количества электричества (в%), расходуемая на превращение данного вещества.
| ЭЛЕКТРОДЫ |
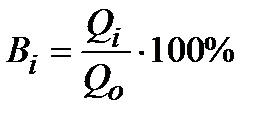
Qi – кол-во электричества, пошедшее на превращение i вещества
Qo – общее кол-во электричества, прошедшее через электрод
Если отсутствуют потери Q на другие процессы ВNa = 100%
Следует помнить: Q A =|Q K |= Q o
ЭЛЕКТРОЛИЗ ВОДНЫХ РАСТВОРОВ
Последовательность протекания электродных процессов зависит от состава электролита, материала электрода, рН, величины поляризации.
Правила катодного восстановления
На катоде в первую очередь восстанавливаются наиболее сильные окислители,
т.е. идет реакция с более + Е. Если разница потенциалов частиц в приэлектродном слое меньше 1В, возможны два и более процесса.
При электролизе окислители делятся на три группы
1.Окислители Е 0ох < < Е 0Н+/Н2
Ионы Ме I A, II A подгупп, стоящих в ряду напряжения выше и вкл. Al на катоде не восстанавливаются, выделяется только Н2.
2. Окислители, Е 0ох > Е 0Н+/Н2
Cu2+, Ag+, Hg2+, Au3+, Pt-Me, O2, и т.д. восстанавливаются в первую очередь,
Н2 не выделяется
3. Окислители Е 0ох - Е 0Н+/Н2 < 1
Ионы Sn2+, Pb2+, Ni2+, Co2+, Zn2+, Cd2+ и др., стоящие в ряду напряжения между Al и Н2.. Два процесса: Меn+ + ne → Me0, 2H+ + 2 e → H2
Правила анодного окисления
в первую очередь окисляются наиболее сильные восстановители, т.е.идет реакция, потенциал которой наименьший
если разница потенциалов частиц в приэлектродном слое меньше 1В, возможны два и более процесса.
Ионы SO42-, NO3-, NO2-, CO32-, PO43- (анионы кислородсодержащих кислот) на аноде не окисляются!!!
В случае электролиза раствора Na2SO4 (электроды Pt)
[- K]: 2Н+ + 2 е → Н2↑
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4 е один процесс на аноде
 В случае электролиза раствора NaCl (электроды Pt)
В случае электролиза раствора NaCl (электроды Pt)
[- K]: 2Н+ + 2 е → Н2↑
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4 е два процесса на аноде
2Cl- → Cl2 ↑ + 2 е
Задача.
Рассмотрите электролиз раствора Na2SO4на растворимых Ni-электродах. Напишите уравнения процессов электролиза. Рассчитайте массы и объемы выделившихся газов (приведенные к н.у.), которые образуются на электродах за 0,2 часа при токе 5А. Вi (О2)=60%.
Решение.Ионный состав раствора:
Na2SO4 ж → 2Na+p + SO42-p
Н2Ож ↔ Н+р + ОН-р
(соль образована сил. осн. и сильн. кислотой нет гидролиза)рН = 7
Равновесные потенциалы возможных электродных процессов
[- K]: Е0Na+/ Na = - 2,9 В ЕрН+/Н2 = - 0,059рН = -0,41 В
[+A]: SO42- - не окисляется, ЕрО2/ОН- =1,23-0,059рН=0,82 В
Е0Ni2+/ Ni = - 0,025 В Þ ∆ E < 1 Þ два процесса
[- K ]: 2Н+ + 2 е → Н2↑ 100%
[+A]: 4ОН- → О2 ↑ + 2Н2О + 4 е 60%
Ni0 → Ni2+ + 2 e 40%
Поиск по сайту: