 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Маневры рекрутирования
|
Читайте также: |
В последнее время при проведении респираторной поддержки у больных с ОРДС большое внимание уделяется проведению маневров рекрутирования - приемам, направленным на максимальное расправление коллабированных альвеол [38]. Суть маневров рекрутирования заключается в создании высокого положительного давления в дыхательных путях в течение 30-120 с. Такая длительность необходима по двум причинам: 1) некоторые альвеолы для полного раскрытия требуют достаточно длительного время; 2) для создания монослоя сурфактанта в заново раскрытых альвеолах также необходимо определенное время. В дальнейшем для предотвращения дерекрутирования (спадения) альвеол достаточно поддержания более низкого транспульмонального давления, т.е. давление закрытия меньше, чем давление открытия, и РЕЕР, необходимый для поддержания альвеол в "открытом" состоянии, гораздо меньше, чем уровень давления во время рекрутирования. Основными методами рекрутирования являются: 1) постоянная инфляция легких для достижения давления в дыхательных путях 30-45 см вод. ст. в течение 1 мин; 2) СРАР 30-45 см вод. ст. в течение 30-60 мин возможно с добавлением поддержки давлением (PS) до 20 см вод. ст.; 3) добавление периодических раздуваний легких - "вздохов" (sighs) с объемами, достаточными для повышения давления в дыхательных путях до 30-45 см вод. ст., 1-2 раза в 1 мин [39].
В нескольких открытых исследованиях были показаны эффекты маневров рекрутирования, которые обычно приводят к улучшению параметров газообмена и механики дыхания. Данные приемы более эффективны у больных с "внелегочными" причинами ОРДС [40]. Причинами низкой эффективности маневров рекрутирования являются: очень вязкий экссудат (при пневмонии); ОРДС, вызванный "легочными" причинами; поздние стадии ОРЛС с развитием выраженного фиброза; субоптимальный уровень давления во время маневров. Потенциальным осложнением маневров является снижение сердечного выброса/артериального давления вследствие повышения интраторакального давления, баротравмы [39].
Неинвазивная вентиляция легких
Неинвазивная вентиляция легких (НВЛ), т.е. вентиляционное пособие без постановки искусственных дыхательных путей (интубационная или трахеостомическая трубка), является относительно новым направлением респираторной поддержки. В отличие от традиционной респираторной поддержки НВЛ позволяет избежать развития многих инфекционных и механических осложнений, в то же время обеспечивая эффективное восстановление газообмена и достижение разгрузки дыхательной мускулатуры у больных с ОДН [41]. Во время НВЛ взаимосвязь пациент - респиратор осуществляется при помощи носовых или лицевых масок, больной находится в сознании и, как правило, не требуется применения седативных и миорелаксирующих препаратов. Масочная вентиляция является более комфортной процедурой, чем обычная вентиляция, - больной может разговаривать, принимать пищу, откашливать мокроту и т.д. В нескольких проспективных исследованиях показана способность НВЛ значительно снижать риск развития как легочных, так и внелегочных инфекций [42]. Основными режимами НВЛ у больных с ОПЛ/ОРДС являются СРАР и PS, чаще всего используются лицевые маски. PS имеет большее предпочтение, так как снижает работу дыхания и обеспечивает отдых дыхательной мускулатуре [43]. В течение первых суток НВЛ обычно проводится постоянно, с короткими перерывами длительностью 10-20 мин.
Необходимо подчеркнуть, что для проведения НВЛ необходим строгий отбор больных, главными критериями являются сохранение сознания и кооперативность больного, а также стабильная гемодинамика [41]. Успех НВЛ, по сводным данным нескольких исследований, составляет 50-60% [41].
Все остальные режимы ИВЛ и методы оксигенации при ОРДС: высокочастотная вентиляция легких, "жидкостная" (флюорокарбоновая) вентиляция легких, экстракорпоральная мембранная оксигенация - пока являются экспериментальными и их место уточняется.
Прональная позиция
Улучшение оксигенации у больного с ОРДС может быть достигнуто за счет прональной позиции (prone positioning), т.е. придание больному положения лежа на животе. Данный прием приводит к улучшению оксигенации примерно у 65% больных с ОРДС [44]. Механизм положительного эффекта прональной позиции связан с: 1) расправлением гравитационно-зависимых ателектазов; 2) улучшением VА/Q баланса; 3) повышением функциональной остаточной емкости легких; 4) мобилизацией бронхиального секрета [45].
Потенциальными проблемами прональной позиции являются: повышенное венозное давление головы (отек лица), повреждение глаз (кератиты, ишемия сетчатки и оптического нерва), смещение эндотрахеальной трубки и сосудистых катетеров, повышение внутрибрюшного давления. Длительность прональной позиции пока четко не установлена, есть рекомендации ее использования до 18 ч в сутки с перерывами для ухода, смены катетеров и т.д. [46]. Многоцентровое рандомизированное контролируемое исследование, проведенное в Италии, включавшее 304 больных с ОРДС, показало, что хотя прональная позиция значительно улучшает показатели оксигенации, она не улучшает выживаемость больных ОРДС [47].
Фармакологическая терапия ОРДС
Ингаляционный оксид азота
Ингаляционный оксид азота (iNO) является селективным вазодилататором, так как вызывает вазодилатацию только в хорошо вентилируемых отделах легких, приводя к уменьшению шунтового кровотока и улучшению оксигенации [48]. Кроме того, iNO снижает давление в легочной артерии, и поэтому его использование целесообразно у больных с ОРДС с недостаточностью правого желудочка. Также iNO обладает потенциалом уменьшения формирования интерстициального отека легкого и снижает секвестрацию нейтрофилов в ткани легких [49].
Клиническая эффективность iNO доказана во многих исследованиях: iNO значительно улучшал показатели оксигенации у больных с ОРДС, однако не приводил к улучшению других показателей - уменьшению длительности пребывания больных в отделении и снижению выживаемости больных (табл. 7) [50-54]. Однако у больных с ОРДС с тяжелой рефрактерной гипоксемией и дисфункцией правого желудочка вследствие легочной гипертензии терапия iNO может иметь решающее значение [55]. В настоящее время использование iNO рекомендовано у больных с рефрактерной гипоксемией (PaO2/FiO2<120) и высоким легочным сопротивлением (PVR>400 dynes-s-cm5), критерием ответа на NO является повышение PaO2/FiO2 как минимум на 20% [56]. Около 40-70% всех больных являются "ответчиками" на iNO. Дозы iNO при ОРДС составляют 2-40 ppm, чаще всего 2-10 ppm [56]сего 2-10 ppm [56]. Эффективность iNO зависит от степени рекрутирования альвеол, выраженности воспалительного процесса.
К побочным эффектам терапии iNO относятся метгемоглобинемия, которая редко превышает 2% и не имеет отрицательного клинического значения, и иногда возникающий синдром отмены (rebound effect), т.е. нарастание гипоксемии и легочной гипертензии после отмены iNO [56].
Препараты сурфактанта
Препараты сурфактанта являются основой терапии респираторного дисстрес-синдрома новорожденных (состояние, обусловленное дефицитом сурфактанта), поэтому предпринимались многократные попытки использования препаратов сурфактанта и у больных с ОРДС. У больных с ОРДС доказано нарушение функции и продукции эндогенного сурфактанта, а также уменьшение его количества [57]. Такие изменения повышают потенциал "затопления" альвеол и их спадения, приводя, таким образом, к снижению легочного комплаенса и усугублению вентиляционно-перфузионного дисбаланса. Задачей введения экзогенного сурфактанта является восстановление нормального поверхностного натяжения в альвеолах. Кроме того, препараты сурфактанта способны уменьшить риск развития нозокомиальной пневмонии ввиду наличия у них антибактериальных свойств [58]. Сурфактант назначается эндотрахеально либо в виде инстилляций при проведении бронхоскопии, либо через небулайзер. По данным Gregory и соавт., бронхоскопические инстилляции бычьего сурфактанта в дозе 100 мг/кг 4 раза в сутки значительно улучшают показатели оксигенации в течение 120 ч и, кроме того, могут улучшить выживаемость больных с ОРДС [59]. В крупном (более 700 больных) рандомизированном исследовании не было показано влияния ингаляционного синтетического сурфактанта (Exosurf) на выживаемость больных ОРДС [60], поэтому изучение данной группы препаратов пока продолжается. Возможно, что эффект терапии препаратами сурфактанта зависит от их природы, дозы, способа и времени назначения. В настоящее время наиболее перспективными считаются препараты сурфактанта, имеющие в своем составе апопротеины (синтетические - SP-B или рекомбинантные - rSP-C), так как благодаря им препараты приобретают поверхностно-активные свойства, близкие к нативным сурфактантам, и противовоспалительную активность.
Глюкокортикостероиды
Несмотря на теоретическую роль глюкокортикостероидов (ГКС) при ОРДС (действие на воспалительные цитокины), их эффективность в ранней фазе ОРДС фактически равна нулю. Более того, в некоторых исследованиях был продемонстрирован повышенный риск развития инфекционных осложнений и даже повышение летальности больных с ОРДС при назначении ГКС [61]. Однако в ранних исследованиях ГКС назначались в относительно больших дозах (до 120 мг/кг в сутки) и в течение относительно короткого времени (2-5 дней). Кроме того, роль ГКС может быть более значима на поздних стадиях ОРДС (позже 5-10-го дня). В недавнем исследовании была показана эффективность метилпреднизолона в "стрессовых" дозах (начало от 2 мг/кг в сутки с постепенным снижением дозы, длительность терапии 32 дня) у больных с фибропролиферативной фазой ОРДС: улучшение индекса повреждения легких, полиорганной недостаточности и выживаемости больных (88% против 38% в контрольной группе) [62].
Антиоксиданты
Существуют веские доказательства роли свободных радикалов в патогенезе ОПЛ/ОРДС: доказано их повреждающее действие на протеины клеток и матрикса, липиды и нуклеиновые кислоты [63]. Системы антиоксидантной защиты у больных с ОРДС истощены: так, концентрация и активность в БАЛ одного из наиболее активных компонентов антиоксидантной защиты - глутатиона - значительно снижена [64]. Назначение предшествеников глутатиона - N-ацетилцистеина и процистеина - усиливает синтез эндогенного глутатиона. В ряде рандомизированных исследований было показано, что назначение средних доз N-ацетилцистеина (70 мг/кг/с) и процистеина (63 мг/кг/с) ускоряет разрешение ОПЛ/ОРДС, повышает сердечный выброс, однако не влияет на выживаемость больных [65].
Прогноз у больных с ОРДС
Прогноз при ОРДС неблагоприятный, летальность больных, как правило, составляет 40-60% [66]. Чаще всего летальность больных ОРДС больше связана с последствиями сепсиса и полиорганной недостаточностью, чем с тяжестью дыхательной недостаточности [67, 68], хотя данные последних работ по изучению протективной вентиляции легких свидетельствую о том, что в ряде случаев смерть больных ОРДС является прямым следствием повреждения легких. В течение последнего десятилетия появились обнадеживающие данные о снижении летальности от ОПЛ/ОРДС. Так, опубликованы данные об уменьшении летальности в крупном госпитале Сиэттла от 53-68% в 1983-1987 гг. до 36% в 1993 г. [69]. Сходные результаты получили специалисты из ведущего госпиталя Великобритании: снижение летальности от 66% в 1990-1993 гг. до 34% в 1994-1997 гг. [70]. Возможным объяснением таких благоприятных перемен в прогнозе ОРДС могут быть разработка и внедрение новых технологий респираторной поддержки, появление новых эффективных методов терапии сепсиса и улучшение общей поддерживающей терапии больных ОРДС [66].
К факторам неблагоприятного прогноза больных ОРДС, по данным исследования Zilberberg и соавт., относятся: сепсис, цирроз печени, ВИЧ-инфекция, опухоли, возраст старше 65 лет [68]. Французские ученые в своем проспективном исследовании на основе анализа данных 259 больных ОРДС показали, что кроме цирроза и сепсиса к независимым факторам-предикторам плохого прогноза также относятся: длительность респираторной поддержки до развития ОРДС, индекс оксигенации, механизм легочного повреждения и развитие дисфункции правого желудочка [67].
Респираторный дистресс-синдром взрослых (РДСВ) — острая дыхательная недостаточность, возникающая при острых повреждениях легких различной этиологии и характеризующаяся некардиогенным отеком легких, нарушениями внешнего дыхания и гипоксией. Синдром описан Эсбахом в 1967 г. и назван по аналогии с дистресс-синдромом новорожденных, который обусловлен врожденным дефицитом сурфактанта. При РДСВ дефицит сурфактанта вторичен. В литературе часто используются синонимы РДСВ: шоковое легкое, некардиогенный отек легких.
По данным Marini в США ежегодно регистрируется 150 000 случаев РДСВ, что составляет 0.6 на 1000 населения.
Этиология
Наиболее частыми причинами РДСВ являются:
· пневмонии (бактериальные, вирусные, грибковые и другой этиологии);
· сепсис;
· шок (септический, анафилактический и др.), длительно протекающий и резко выраженный;
· синдром диссеминированного внутрисосудистого свертывания (острое и подострое течение);
· аспирация рвотных масс, воды (при утоплении);
· травмы грудной клетки и синдром длительного сдавления;
· вдыхание раздражающих и токсичных веществ: хлора, окислов азота, фосгена, аммиака, чистого кислорода (кислородная интоксикация);
· эмболия легочной артерии (жировая, воздушная, амниотической жидкостью);
· массивные гемотрансфузии, при которых развиваются множественные микротромбоэмболии в сосудистом русле легких. Это обусловлено тем, что в консервированной крови до 30% эритроцитов находится в виде микроагрегатов до 40 мкм в диаметре и легкие, являясь своеобразным фильтром, задерживают эти микроагрегаты и легочные капилляры закупориваются. Кроме этого, из эритроцитов выделяется серотонин, вызывающий спазм легочных артериол и капилляров;
· венозная перегрузка жидкостью (коллоидными и солевыми растворами, плазмой, плазмозаменителями, жировыми эмульсиями);
· применение аппарата искусственного кровообращения (постперфузионный РДСВ);
· тяжелые метаболические нарушения (диабетический кетоацидоз, уремия);
· острый геморрагический панкреонекроз. В развитии РДСВ при остром панкреатите огромное значение имеет ферментная интоксикация, вызывающая нарушение синтеза сурфактанта (В. Д. Малышев).Особенно большая роль отводится ферменту лецитиназе А, который интенсивно разрушает сурфактант, что приводит к развитию альвеолярных ателектазов, облитерирующих альвеолитов, предрасполагает к развитию пневмоний;
· аутоиммунные заболевания — системная красная волчанка, синдром Гудпасчера и др.;
· длительное пребывание на большой высоте.
Патогенез
Под влиянием этиологических факторов в легочных капиллярах, интерстициальной ткани легких скапливается большое количество активированных лейкоцитов и тромбоцитов. Предполагается, что они выделяют большое количество биологически активных веществ (протеиназ, простагландинов, токсических кислородных радикалов, лейкотриенов и др.), которые повреждают альвеолярный эпителий и эндотелий сосудов, изменяют тонус бронхиальной мускулатуры, реактивность сосудов, стимулируют развитие фиброза.
Под влиянием вышеназванных биологических веществ происходит повреждение эндотелия капилляров легких и альвеолярного эпителия, резко увеличивается сосудистая проницаемость, спазмируются легочные капилляры и повышается давление в них, наблюдается выраженное пропотевание плазмы и эритроцитов в альвеолы и интерстициальную ткань легких, развивается отек легких и ателектаз. Развитию ателектаза способствует также и вторичное снижение активности сурфактанта.
Патогенез РДСВ представлен на рисунке.
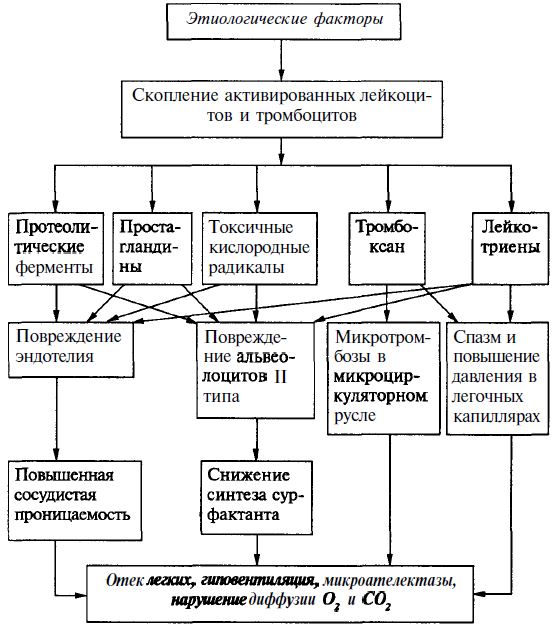
В результате названых процессов развиваются основные патофизиологические механизмы: гиповентиляция альвеол, шунтирование венозной крови в артериальное русло, нарушение соответствия между вентиляцией и перфузией, нарушение диффузии кислорода и углекислого газа.
Патоморфология
РДСВ развивается в течение времени от нескольких часов до 3 суток от начала воздействия этиологического фактора. Различают три патоморфологических фазы РДСВ: острую, подострую и хроническую.
Острая фаза РДСВ длится 2-5 суток и характеризуется развитием интерстициального, а затем альвеолярного отека легких. В отечной жидкости содержатся белок, эритроциты, лейкоциты. Наряду с отеком выявляется поражение легочных капилляров и выраженное повреждение альвеолярного эпителия I и II типов. Повреждение альвеолоцитов II типа приводит к нарушению синтеза сурфактанта, вследствие чего развиваются микроателектазы. При благоприятном течении РДСВ через несколько дней острые явления стихают, отечная жидкость рассасывается. Однако такое благоприятное течение РДСВ наблюдается не всегда. У части больных РДСВ переходит в подострую и хроническую фазу.
Подострая фаза характеризуется интерстициальным и бронхоальвеолярным воспалением.
Хроническая фаза РДСВ — это фаза развития фиброзирующего альвеолита. В альвеолярно-капиллярной базальной мембране разрастается соединительная ткань, мембрана резко утолщается, уплощается. Наблюдается выраженная пролиферация фибробластов и усиленный синтез коллагена (его количество увеличивается в 2-3 раза).
Выраженный интерстициальный фиброз может сформироваться уже через 2-3 недели. В хронической фазе наблюдаются также изменения в сосудистом русле легких — запустевание сосудов, развитие микротромбозов. В конечном итоге развиваются хроническая легочная гипертензия и хроническая дыхательная недостаточность.
Клиническая картина
В клинической картине РДСВ принято выделять 4 периода.
I период — скрытый или период воздействия этиологического фактора. Он продолжается около 24 ч после воздействия этиологического фактора. В этом периоде происходят патогенетические и патофизиологические изменения, но они не имеют никаких клинических и рентгенологических проявлений. Однако часто наблюдается тахипноэ (число дыханий более 20 в минуту).
II период — начальных изменений, развивается в 1-2 сутки от начала действия этиологического фактора. Основными клиническими симптомами этого периода являются умеренно выраженная одышка, тахикардия. При аускультации легких могут определяться жесткое везикулярное дыхание и рассеянные сухие хрипы.
На рентгенограммах легких отмечается усиление сосудистого рисунка, преимущественно в периферических отделах. Эти изменения свидетельствуют о начинающемся интерстициальном отеке легких.
Исследование газового состава крови или не дает отклонений от нормы или выявляет умеренное снижение РаО2.
III период — развернутый или период выраженных клинических проявлений, характеризуется выраженной симптоматикой острой дыхательной недостаточности. Появляется выраженная одышка, в дыхании участвует вспомогательная мускулатура, хорошо видно раздувание крыльев носа и втягивание межреберных промежутков, наблюдается выраженный диффузный цианоз. При аускультации сердца обращают на себя внимание тахикардия и глухость сердечных тонов, значительно снижается артериальное давление.
При перкуссии легких определяется притупление перкуторного звука, больше в задненижних отделах, аускультативно — жесткое дыхание, могут прослушиваться сухие хрипы. Появление влажных хрипов и крепитации указывает на появление жидкости в альвеолах (альвеолярный отек легких различной степени выраженности).
На рентгенограмме легких определяется выраженный интерстициальный отек легких, а также двусторонние инфильтративные тени неправильной облаковидной формы, сливающиеся с корнями легких и друг с другом. Очень часто в краевых отделах средней и нижней долей на фоне усиленного сосудистого рисунка появляются очаговоподобные тени.
Характерным для этого периода является значительное падение РаО2 (менее 50 мм рт.ст., несмотря на ингаляцию кислорода).
IVпериод — терминальный, он характеризуется выраженным прогрессированием дыхательной недостаточности, развитием выраженной артериальной гипоксемии и гиперкапнии, метаболического ацидоза, формированием острого легочного сердца вследствие нарастающей легочной гипертензии.
Основными клиническими симптомами этого периода являются:
o выраженная одышка и цианоз;
o профузнаявпотливость;
o тахикардия, глухость сердечных тонов, нередко разнообразные аритмии;
o резкое падение артериального давления вплоть до коллапса;
o кашель с отделением пенистой мокроты розового цвета;
o большое количество влажных хрипов разного калибра в легких, обильная крепитация (признаки альвеолярного отека легких);
o развитие признаков нарастающей легочной гипертензии и синдрома острого легочного сердца (расщепление и акцент II тона на легочной артерии; ЭКГ-признаки — высокие остроконечные зубцы Ρ в отведениях II, III, avF, V1-2; выраженное отклонение электрической оси сердца вправо; рентгенологические признаки повышения давления в легочной артерии, выбухание ее конуса);
o развитие полиорганной недостаточности (нарушение функции почек, что проявляется олигоанурией, протеинурией, цилиндрурией, микрогематурией, повышением содержания в крови мочевины, креатинина; нарушение функции печени в виде легкой желтушности, значительного повышения содержания в
o крови аланиновой аминотрансферазы, фруктозе-1-фосфатальдолазы, лактатдегидрогеназы; нарушение функции головного мозга в виде заторможенности, головных болей, головокружения, возможны клинические признаки нарушения мозгового кровообращения).
Исследование газового состава крови выявляет глубокую артериальную гипоксемию, гиперкапнию, исследование кислотно-щелочного равновесия — метаболический ацидоз.
Диагностика
Fisher и Foex предложили следующие диагностические критерии РДСВ:
o нарушение дыхания (выраженная одышка);
o большая работа дыхания, нарастающая ригидность грудной клетки;
o клиническая картина нарастающего отека легких;
o типичная рентгенологическая картина (усиление легочного рисунка, интерстициальный отек легких);
o артериальная гипоксемия (обычно РаО2 меньше 50 мм рт. ст.) и гиперкапния;
o гипертензия в малом круге кровообращения (давление в легочной артерии более 30/15 мм рт. ст.);
o нормальное давление заклинивания легочной артерии (<15 мм рт. ст.). Определение этого критерия важно для дифференциации РДСВ от кардиогенного отека легких, для которого характерно повышение давления заклинивания легочной артерии;
o рН артериальной крови меньше 7.3.
Программа обследования
1. Общий анализ крови, мочи.
2. ЭКГ.
3. Рентгенография легких.
4. Исследование кислотно-щелочного равновесия.
5. Исследование газового состава крови: определение РаО2, РаСО2.
Острый респираторный дистресс-синдром взрослых – тяжёлая форма дыхательной недостаточности, характеризующаяся специфическими изменениями в лёгких – диффузной инфильтрацией, сопровождающейся некардиогенным отёком, альвеолярным коллапсом, острой дыхательной недостаточностью. Несмотря на различие этиологических факторов, они прямо или косвенно воздействуют на лёгкие, вызывая повреждение лёгочных структур. Главным признаком синдрома является гипоксемия, отражающая несостоятельность транспорта кислорода в лёгких. Этот синдром известен под названиями "шоковое", "травматические", "влажное" лёгкие.
Поиск по сайту: