 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Химические свойства. 1). Реакции электрофильного присоединения
1). Реакции электрофильного присоединения
а) Присоединение галогенов
R-CH=CH-R ¢ + X2 ® R-CHX-CHX-R ¢
Механизм присоединения брома:
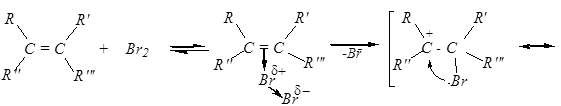
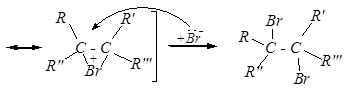

Присоединение хлора к разветвлённым алкенам имеет свои особенности:

изобутилен (2-метилпропен) 3-хлор-2-метилпропен
б) Присоединение галогеноводородов.
HF < HCl < HBr < HI
R-CH=CH2 + НХ ® R-CHX-CH3
Правило Марковникова: протон из кислот присоединяется к более гидрированному атому углерода кратной связи.
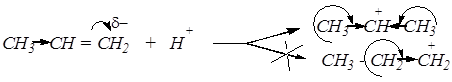
1) Распределение электронной плотности в молекуле исходного углеводорода.
2) Устойчивость образующегося вторичного карбониевого иона за счёт индуктивных эффектов и эффектов s- р -сопряжения.

(например, Х = - CN, -COOH, -CF3)
в) Присоединение воды (гидратация), спиртов.
R-CH=CH2 + Н+ ® R-CH+-CH3  R-CHОН-CH3 + Н+
R-CHОН-CH3 + Н+
электрофил
При промышленной гидратации этилена в качестве катализатора используют систему Н3PO4 / SiO2 при температуре около 300°С и давлении 7 МПа.
г) Гидроборирование.
Алкены ® первичные спирты.
R-CH=CH2 + BН3 ® R-CH2-CH2-BH2
алкилборан
R-CH2-CH2-BH2 + 2 R-CH=CH2 ®(R-CH2-CH2-) 3B
(R-CH2-CH2-) 3B  (R-CH2-CH2-О-) 3B
(R-CH2-CH2-О-) 3B
(R-CH2-CH2-О-) 3B  R-CH2-CH2OH + Н3BО3
R-CH2-CH2OH + Н3BО3
При присоединении хлорноватистой и бромноватистой кислот (реакция гипогалогенирования) электрофилами являются катионы галогенов Cl+ и Br+:
HOCl + Н+ ® H2O+-Cl ® Cl + + H2O
Алкены ® галогеналканы, спирты (первичные, вторичные и третичные).
Реакционная способность
CH2=CH2 1
CH2=CH-С2H5 100
цис - CH3-CH=CH-С2H5 4300
(CH3)2C=C(СH3)2 106
2). Реакции радикального присоединения
R-CH=CH2 + HBr 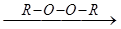 R-CH2-CH2-Br
R-CH2-CH2-Br
Реакция идёт по радикальному механизму только в присутствии пероксидов.
R-O-O-R ®2 R-O ×
R-O × + H: Br ® R-OH + Br ×
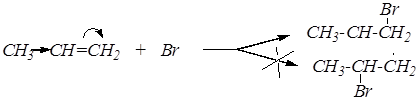
«против правила Марковникова»:
1) образование более стабильного радикала,
2) доступность менее замещённого атома углерода,
3) бóльшая величина электронной плотности на этом атоме.
третичный > вторичный > первичный
В присутствии пероксидов присоединяется только HBr
3). Реакции радикального замещения
Характерны для пропена и других гомологов этилена, имеющих хотя бы один a-водородный атом.
Протекают только при высоких температурах (400—500°С).
a
R-CH2-CH2-CH=CH2 + Cl2 ® R-CH2-CHCl-CH=CH2 + HCl
Такое направление реакции (предпочтительное замещение, а не присоединение) объясняется образованием очень устойчивого радикала, стабилизированного р- p-сопряжением:

р- p-сопряжение — это перекрывание орбиталей p - связи с р- орбиталью соседнего атома углерода. При этом происходит перераспределение электронной плотности (более равномерное её распределение между всеми тремя р- орбиталями).
При высокой температуре легко преодолевается энергетический барьер разрыва как p-связи, так и s-связи C–H, и реакция идёт через образование данного радикала. При этом мезомерный радикал, реагируя с молекулой хлора, может давать два изомерных продукта:
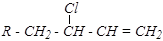
| и | 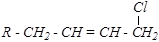
|
4). Изомеризация
Реакция изомеризации для углеводородов с двойной связью, — это цис-транс -изомеризация:
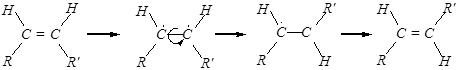
Структурная изомеризация (при температуре выше 400°С):
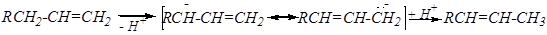
5). Полимеризация
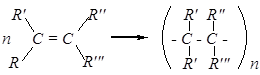

где n — степень полимеризации
6). Окисление
а) Окисление кислородом воздуха без катализатора и окисление с помощью SeO2.
В зависимости от условий образуются непредельные спирты или карбонильные соединения.
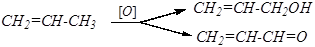
| аллиловый спирт акролеин |
б) Образование эпоксисоединений (органических окисей):
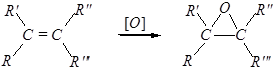
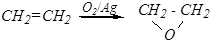
Для других алкенов применяют органические пероксикислоты RCOOOH (реакция Прилежаева).
в) Реакция Вагнера.
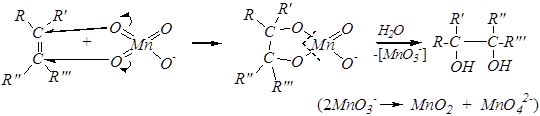
Это окисление этиленовых углеводородов разбавленным (1%-м) раствором KMnO4 в щелочной среде с образованием гликолей.
Тот же продукт окисления образуется и при окислении алкенов тетраоксидом осмия OsO4.
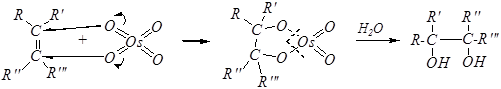
г) Окисление в жёстких условиях.
При действии концентрированного раствора KMnO4 или раствора K2Cr2O7.

д) Озонирование (озонолиз).
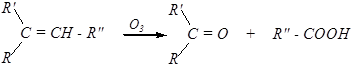
Механизм:

1,2,3-триоксолан
(первичный озонид)

1,2,4-триоксолан (вторичный озонид)
Такие озониды неустойчивы и гидролизуются:
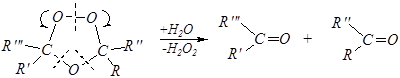
Если озонирование заканчивается расщеплением озонида, то говорят об озонолизе.
Но чаще расщепление озонида проводят в присутствии слабых восстановителей (например, сульфитов) и при этом вместо карбоновых кислот образуются альдегиды — способ получения альдегидов (и кетонов).
Поиск по сайту: