 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Зависимость от вязкости растворителя
Правило Вальдена–Писаржевского выражает закономерность зависимости молярной электропроводности при бесконечном разведении от вязкости растворителя  :
:  , если характер сольватации не меняется при переходе от растворителя к растворителю. В противном случае приходится учитывать диэлектрическую проницаемость среды (А.М. Шкодин):
, если характер сольватации не меняется при переходе от растворителя к растворителю. В противном случае приходится учитывать диэлектрическую проницаемость среды (А.М. Шкодин):  .
.
ПОДВИЖНОСТЬ ИОНА И ЧИСЛА ПЕРЕНОСА
Электропроводность электролитов связана со скоростями движения ионов в растворе. Скорость движения wi [м×с-1] иона в растворе про-порциональна напряженности приложенного электрического поля Е [В×м-1]:
wi = uiE.
Коэффициент пропорциональности u [м2×с-1×В-1] называется абсолютной подвижностью иона.
Произведение uiF (F - постоянная Фарадея) называется подвижностью иона li [Ом-1×м2×моль-1]:
li = uiF.
Подвижность иона при бесконечном разбавлении называется предельной подвижностью иона и обозначается  .
.
Согласно закону Кольрауша о независимой миграции ионов, молярная электропроводность раствора при бесконечном разведении равна сумме предельных подвижностей катионов и анионов:
 .
.
Доля тока, переносимая данным ионом, называется числом переноса ti иона:  , причем по определению
, причем по определению 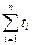 =1.
=1.
АКТИВНОСТЬ ЭЛЕКТРОЛИТОВ
Свойства реальных растворов описываются уравнениями, в которых вместо концентраций вводится активность. Активность иона аi выражается в виде произведения концентрации иона mi, на его коэффициент активности gi:
аi = gi mi.
Экспериментально определить активности катиона а+ и аниона а- невозможно, поэтому вводится понятие средней ионной активности а±. Для электролита, образующего n+ катионов и n- анионов,

 ,
,
где n = n++n-.
Аналогично определяют средний ионный коэффициент активности g±
 ,
,
и среднюю ионную моляльность m±
 ,
,
где m = m+/n+ = m-/n-- - моляльность электролита.
Активность электролита определяется как
а = (а±)n = (g±m±)n = g±nmn(n+n+n-n-).
Согласно закону ионной силы, коэффициенты активности ионов не зависят от конкретного вида ионов, находящихся в растворе, а зависят от ионной силы I раствора:
I = ½åmizi2,
где zi - заряд иона (в единицах заряда протона), mi - его моляльная концентрация.
Согласно первому приближению теории Дебая-Хюккеля, можно рассчитать коэффициент активности gi отдельного иона
lggi = -Azi2  ,
,
и средний ионный коэффициент активности g±:
lgg± = -A½z+ z-½  ,
,
где z+ и z- - заряды катиона и аниона, I - ионная сила раствора, А - константа, зависящая от диэлектрической проницаемости растворителя и температуры. Для водного раствора при 25 °С А=0,509.
ПРАКТИЧЕСКОЕ ПРИЛОЖЕНИЕ КОНДУКТОМЕТРИЧЕСКИХ ИЗМЕРЕНИЙ
Определение электропроводности называют кондуктометрическими измерениями.
1. Экспериментальное определение констант диссоциации слабых электролитов.
 Þ
Þ  , где
, где  - табличная величина. В свою очередь молярную электрическую проводимость можно вычислить по формуле: l=1000·æ/С [См·см2/моль]. При этом удельная электропроводность æ измеряется опытным путем.
- табличная величина. В свою очередь молярную электрическую проводимость можно вычислить по формуле: l=1000·æ/С [См·см2/моль]. При этом удельная электропроводность æ измеряется опытным путем.
2. Определение концентрации труднорастворимых веществ и их растворимости.
Определение растворимости основано на том, что насыщенный раствор малорастворимых электролитов можно считать бесконечно разбавленным. Измеряя удельную электропроводность такого раствора и рассчитывая для него молярную электропроводность, определяют его концентрацию, т.е. растворимость электролита.
l=1000·æ/С Þ С=1000·æ/l;  (табличные значения).
(табличные значения).
 .
.
3. Кондуктометрическое титрование.
Этот способ является особенно ценным в случае мутных или окрашенных растворов, которые титровать с применением обычных индикаторов часто невозможно.
Этот метод основан на замене ионов титруемого вещества ионами добавляемого реагента в процессе титрования. Так как в общем случае подвижности указанных ионов разные, то в точке эквивалентности всегда наблюдается резкое изменение электропроводности. Например, титруем сильную кислоту HCl сильным основанием NaCl^
H+ + Cl- + Na+ + OH- = H2O + Na+ + Cl-.
В ходе титрования более подвижные ионы водорода заменяются менее подвижными ионами натрия, поэтому электропроводность падает. После т.э. появляются дополнительные ионы натрия и гидроксида, и электропро-водность растет. Преимущества метода: не нужно титровать по каплям.
Можно титровать сильную кислоту  сильным основанием, слабую кислоту сильным основанием или смесь сильной и слабой кислот.
сильным основанием, слабую кислоту сильным основанием или смесь сильной и слабой кислот.
Поиск по сайту: