 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Scenedesmus quadricauda (Turp) Breb
|
Читайте также: |
Определение острой и хронической токсичности сточных, поверхностных и подземных вод, донных отложений (водных вытяжек), буровых растворов, водных растворов отдельных веществ и их смесей можно
бихромата калия и серной кислоты (хромовой смесью), затем тщательно водопроводной водой и 3-4 раза дистиллированной водой. Посуду, используемую для культивирования и биотестирования, за исключением мерной, стерилизуют в сушильном шкафу при 160°С в течение 1,5 ч. Не разрешается пользоваться для мытья посуды синтетическими поверхностно-активными веществами и органическими растворителями. Можно пользоваться питьевой содой.
При культивировании периодически обновляют культуру водорослей, пересевая ее на свежую питательную среду не реже одного раза в 10 дней. Для этого в стерильную колбу объемом 250-300 см3 со свежей средой Прата объемом 150 см3 над пламенем спиртовки наливают 15-20 см3 верхнего слоя исходной культуры (содержимое исходной культуры при этом не перемешивают). Начальная плотность клеток в новой колбе составляет примерно 100-150 тыс. кл/см3, что дает светло-зеленую окраску. В случае ослабления интенсивного роста клеток в культуре, к питательной среде добавляют витамин В12.
После посева колбу закрывают стерильной ватно-марлевой пробкой и бумажным колпачком, перемешивают и помещают в люминостат. В процессе культивирования культуру водорослей периодически перемешивают, встряхивая 1 -2 раза в сутки.
При биотестировании используют 3-х суточную культуру водорослей, находящуюся в экспоненциальной фазе роста. Через 3-е суток подсчитывают численность клеток (которая должна составлять примерно 5 млн.кл/см3).
Далее расчетным путем устанавливают, какое количество культуры водорослей необходимо взять, чтобы получить в опытном и контрольном объеме среды Прата необходимую плотность клеток по 30 тыс. кл/см3 (как правило это 0,5-1 см3 культуры водорослей).
Для подсчета количества клеток водорослей используют счетную камеру Горяева (или другую).
Повторность в опыте и контроле трехкратная.
В опытные и контрольные колбы вносят по 0,5 см3 исходной культуры водорослей S. quadricauda в экспоненциальной фазе роста численностью около 5 млн. кл/см3 (при этом численность клеток водорослей в опытных и контрольных колбах будет составлять около 30 тыс. кл/ см3).
После этого колбы закрывают ватно-марлевыми пробками, встряхивают и помещают в люминостат. Затем считают численность клеток ежедневно, тщательно перемешивая содержимое колб, в течение 3-х суток в остром опыте и 7-и суток - в хроническом.
Через 72 ч или 7 суток биотестирование прекращают. В каждой колбе подсчитывают численность клеток водорослей.
Для каждого параллельного определения в опыте и контроле вычисляют среднее арифметическое численности клеток водорослей в 1 см3.
На основании результатов трех параллельных определений численности клеток водорослей в контроле и опыте находят средние арифметические численности клеток водорослей в контроле (опыте)).
Рассчитывают численность клеток водорослей в опыте в процентах от их численности в контроле. Принимая численность в контроле за 100%, находят увеличение (уменьшение) численности водорослей в опыте в процентах (Р).
Вывод о наличии или отсутствии токсичности анализируемой пробы воды (водной вытяжки), бурового раствора или раствора вещества (смеси веществ) делают на основании величины Р (изменение численности по сравнению с контролем в процентах). Проба воды (водная вытяжка), раствор вещества (смеси веществ) считается токсичной (токсичным), если величина Р составляет 50% и менее.
Лабораторная работа №9. Виды-индикаторы зоопланктона
Зоопланктон представляет собой сообщество беспозвоночных животных, населяющих толщу воды. Изменение условий существования организмов отражается на видовом составе, количественных показателях, соотношении отдельных таксономических групп зоопланктона.
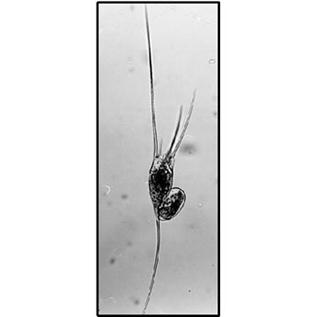
Рисунок 8. Kellicottia longispina ο – 1.25(Rotatoria)
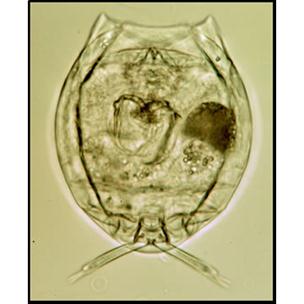
Рисунок 9. Lecane luna οβ – 1.55 (Rotatoria)

Рисунок 10. Keratella quadrata οβ – 1.55(Rotatoria)

Рисунок 11. Brahionus calyciflorus βα – 2.5(Rotatoria)
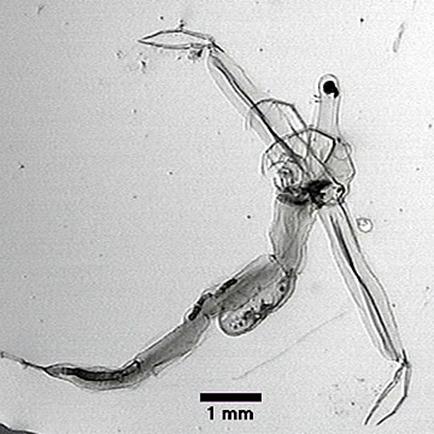
Рисунок 12. Leptodora kindtii- οβ – 1.65(Cladocera)
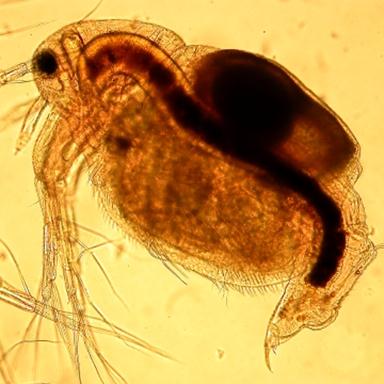
Рисунок 13. Moina macrocopa α – 2.75(Cladocera)

Рисунок 14. Daphnia magna αρ- 3.4 (Cladocera)
Задание. Рассмотреть в камере Богорова под бинокуляром виды зоопланктона, имеющие разную степень сапробности. Зарисовать. Указать на особенности биоиндикации вод по зоопланктону.
Лабораторная работа №10. Биотестирование вод на токсичность по гибели ракообразных Daphnia magna Straus
Определение острой токсичности сточных, поверхностных и подземных вод, донных отложений (водных вытяжек), буровых растворов, водных растворов отдельных веществ и их смесей можно проводить по гибели ракообразных Daphnia magna Straus
Методика основана на установлении различия между количеством погибших дафний в анализируемой пробе (опыт) и культивационной воде (контроль).
Критерием острой летальной токсичности является гибель 50% дафний и более в опыте по сравнению с контролем за 96 ч биотестирования.
Материалы и реактивы: лупа складная; воронки разные лабораторные; колбы мерные, вместимостью 0,5 и 1,0 дм3; бумага фильтровальная; вата и марля для изготовления ватно-марлевых пробок; пипетки мерные вместимостью от 1 до 10 см3; посуда стеклянная: вместимостью 2 дм3 для культивирования дафний; вместимостью от 100 до 150 см3 для биотестирования; трубки стеклянные внутренним диаметром 5-7 мм для отлова дафний; цилиндры мерные вместимостью 0,1; 0,5 и 1,0 дм3; дрожжи хлебопекарные; культура зеленых водорослей (для корма - родов Chlorella или Scenedesmus);
Биотестирование проводят в помещении, где не хранят и не работают с летучими веществами, не используют обработку помещения инсектицидами.
Объем пробы воды (водной вытяжки), бурового раствора, раствора вещества (смеси веществ) для определения острой летальной токсичности должен быть не менее 1 дм3.
Температура анализируемой пробы при биотестировании должна быть (20±2)°С, концентрация кислорода в пробе в начале биотестирования - не менее 6 мг/дм3. Если его концентрация ниже 6 мг/дм3, пробу аэрируют микрокомпрессором. Воздух должен подаваться равномерно до достижения концентрации кислорода 6 мг/дм3. Во время биотестирования пробу не аэрируют.
Битестирование проводят при рассеянном свете. Не допускается попадание прямых солнечных лучей на тест-объект. Длительность светового периода соответствует естественному.
Плотность посадки односуточных дафний в опыте и контроле должна составлять 10 экземпляров на 100 см3. Повторность трехкратная.
Результаты учитывают, если в конце биотестирования концентрация кислорода в анализируемых пробах была не менее 2 мг/дм3, температура воды составляла (20±2)°С, количество погибших дафний в контроле не превышало 10%.
В качестве тест-объекта используют лабораторную культуру дафний - Daphnia magna Straus (Cladocera, Crustacea).
Культуру дафний выращивают в стеклянной посуде вместимостью до 2 дм3. Посуду моют питьевой содой и тщательно ополаскивают дистиллированной водой. Нельзя применять синтетические моющие средства и органические растворители.
Для культивирования дафний используют питьевую воду. Пересаживают дафний при помощи стеклянной трубки внутренним диаметром 5-7 мм так, чтобы их не травмировать. Для этого конец трубки помещают под поверхность воды и держат до тех пор, пока дафнии не перейдут в трубку. Аэрировать воду в посуде с дафниями не рекомендуется.
Дафний кормят один раз в сутки суспензией зеленых водорослей и один раз в неделю - суспензией хлебопекарных дрожжей.
В качестве водорослевого корма для дафний рекомендуется использовать зеленые протококковые водоросли - сценедесмус или хлореллу.
Для биотестирования используют дафний в возрасте до 24 ч, которых кормят за 2-3 ч до начала биотестирования. Чтобы получить необходимое количество тест-объектов для биотестирования, 20-30 самок дафний с выводковыми камерами, полными яиц или зародышей, за одни сутки до биотестирования пересаживают в стеклянную посуду емкостью от 0,5 до 1,0 дм3 с водой для культивирования и вносят корм. После появления молоди (каждая самка может выметать от 10 до 40 молодых дафний) взрослых особей удаляют.
Задание. Пробу воды соответствующего разбавления наливают в стеклянные сосуды по 100 см3 (опыт). Другие сосуды наполняют таким же объемом отфильтрованной воды из емкостей, где культивируются дафнии (контроль). Повторность в опыте и контроле трехкратная.
В каждый опытный и контрольный сосуд помещают по 10 дафний в возрасте до 24 ч. Их быстро переносят стеклянной трубкой диаметром 5-7 мм, погрузив ее в воду. Продолжительность биотестирования составляет 96 ч. Во время биотестирования дафний не кормят.
В конце биотестирования визуально подсчитывают количество живых дафний. Живыми считают дафний, которые свободно передвигаются в толще воды или всплывают со дна сосуда не позже, чем через 15 сек после его легкого встряхивания. Остальных дафний считают погибшими.
На основании результатов трех параллельных определений количества живых дафний в контроле и опыте находят средние арифметические количества живых дафний в контроле (опыте).
Рассчитывают в процентах количество погибших дафний в опыте по отношению к контролю.
Вывод о наличии или отсутствии острой летальной токсичности пробы воды (водной вытяжки), бурового раствора или раствора вещества (смеси веществ) делают на основании величины А (процента гибели дафний в опыте по отношению к контролю). Если величина А составляет 50% дафний и более, считают, что анализируемая проба проявляет острую летальную токсичность.
Поиск по сайту: