 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Лекция 7. Фенолы
Органическая химия.
Тема: ««Кислородсодержащие органические соединения»
Лекция 7. Фенолы
План.
1. Понятие о фенолах, их классификация, номенклатура фенолов.
2. Строение молекулы и физические свойства фенола.
3. Химические свойства фенола.
4. Получение и применение фенола.
1.
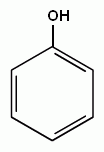
ФЕНОЛЫ – класс органических соединений, которые содержат одну или несколько группировок –ОН, соединенного непосредственно с атомами углерода бензольного кольца.
Классификация фенолов. 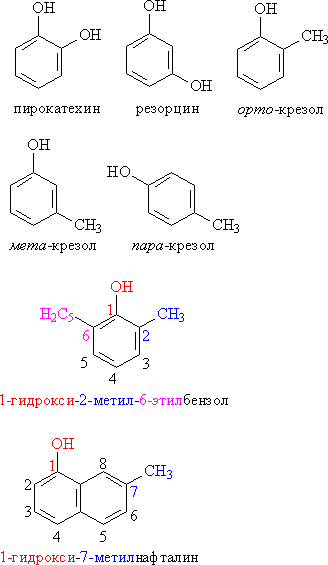
Рис. 1. ОДНО-, ДВУХ- И ТРЕХАТОМНЫЕ ФЕНОЛЫ

Рис. 2. МОНО- И ПОЛИЯДЕРНЫЕ ФЕНОЛЫ


Номенклатура. Для фенолов широко используют тривиальные названия, сложившиеся исторически. В названиях замещенных моноядерных фенолов используются также приставки орто-, мета- и пара -, употребляемые в номенклатуре ароматических соединений. Для более сложных соединений нумеруют атомы, входящие в состав ароматических циклов и с помощью цифровых индексов, указывают положение заместителей.
Физические свойства фенола. Бесцветное кристаллическое вещество, температура плавления 41 оС, обладает характерным запахом. Многоатомные фенолы запаха не имеют. При хранении кристаллы становятся розоватыми, потом фиолетовыми. В холодной воде фенол растворяется очень плохо (8 г в 100 мл при 15Со), но при нагревании граница раздела между жидким фенолом и водой постепенно исчезает, раствор становиться прозрачным. Фенол вызывает денатурацию белка, поэтому обладает антисептическими свойствами. При попадании на кожу может вызвать ожоги. На коже появляются белые пятна, которые позже темнеют. При попадании в организм вызывает тяжелые отравления.
 Строение молекулы фенола. Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Фенильная группа (С6Н5-) оттягивает на себя неподеленную электронную пару от атома кислорода в ОН-группе. В результате на атоме Н этой группы увеличивается частичный положительный заряд (обозначен значком δ+), полярность связи О–Н возрастает, и связь разрывается легче, что проявляется в увеличении кислотных свойств этой группы. Таким образом, в сравнении со спиртами, фенолы представляют собой более сильные кислоты. Частичный отрицательный заряд (обозначен через δ–), переходя на фенильную группу, сосредотачивается в положениях орто- и пара- (по отношению к ОН-группе). Эти реакционные точки могут атаковаться реагентами, тяготеющими к электроотрицательным центрам, так называемыми электрофильными («любящими электроны») реагентами.
Строение молекулы фенола. Бензольное ядро и ОН-группа, объединенные в молекуле фенола, влияют друг на друга, существенно повышая реакционную способность друг друга. Фенильная группа (С6Н5-) оттягивает на себя неподеленную электронную пару от атома кислорода в ОН-группе. В результате на атоме Н этой группы увеличивается частичный положительный заряд (обозначен значком δ+), полярность связи О–Н возрастает, и связь разрывается легче, что проявляется в увеличении кислотных свойств этой группы. Таким образом, в сравнении со спиртами, фенолы представляют собой более сильные кислоты. Частичный отрицательный заряд (обозначен через δ–), переходя на фенильную группу, сосредотачивается в положениях орто- и пара- (по отношению к ОН-группе). Эти реакционные точки могут атаковаться реагентами, тяготеющими к электроотрицательным центрам, так называемыми электрофильными («любящими электроны») реагентами.
Химические свойства. Для фенолов возможны два типа превращений: замещение водорода в ОН-группе и замещение водорода в бензольном ядре.
1. Реакции замещения атома водорода в ОН-группе. При действии на фенолы щелочных металлов или щелочей образуются феноляты. Кислотность фенолов значительно выше, чем у спиртов. Повышенная кислотность фенолов проявляется в том, что они взаимодействуют с водными растворами щелочей (реакция нейтрализации), образуя соли феноксиды (или феноляты). Причина этого – смещение электронной плотности гидроксогруппы в сторону бензольного кольца (фенил – акцептор электронной плотности) и поляризация связи между кислородом и водородом в гидроксогруппе.

Феноляты могут существовать в водных щелочных растворах (в отличии от алкоголятов). Но при пропускании углекислого газа через раствор фенолята выделяется свободный фенол. Значит карболовая кислота, так часто называют фенол, более слабая, чем угольная кислота. Но если в бензольное кольцо ввести электроотрицательный заместитель (например, нитрогруппу), то полярность связи О-Н увеличивается и тринитрофенол по кислотности приближается к сильным минеральным кислотам, поэтому его называют пикриновой кислотой.
2. Пара электронов атома кислорода, оттянутая к бензольному кольцу, увеличивает прочность связи С–О, поэтому реакции, протекающие с разрывом этой связи (нуклеофильное замещение), характерные для спиртов, для фенолов не типичны, но возможны. При взаимодействии с аммиаком (повышенная температура и давление) происходит замена ОН-группы на NH2, образуется анилин. Возможно и нуклеофильное замещение на галогены, но для реакции замещения с галогеноводородами лучше вместо фенола брать фенолят натрия.

3. Реакции замещения атомов водорода в бензольном кольце, характерные для бензола, будут протекать и для фенолов. При галогенировании, нитровании и некоторых других реакциях атакуются центры с повышенной
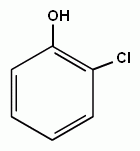
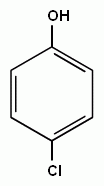
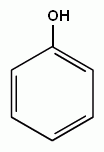
| + Cl2→ |
| + HCl |
| или |
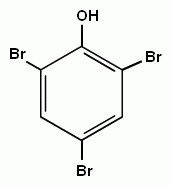
| + HBr |
| +Br2→ |
электронной плотностью, т.е. замещение проходят преимущественно в орто- и пара- положениях и, кроме того, значительно легче происходит замещение двух и трех атомов водорода в бензольном кольце.
4. С раствором хлорида железа (Ш) фенолы дают цветное окрашивание. Например, раствор фенол окрашивает раствор в сине-фиолетовый цвет. Эту реакцию часто используют как качественную, для определения присутствия фенола.
Способы получения фенолов. Фенолы выделяют перегонкой из каменноугольной смолы, а также из продуктов пиролиза бурых углей и древесины (деготь). Промышленный способ получения фенола С6Н5ОН основан на окислении ароматического углеводорода кумола (изопропилбензол) кислородом воздуха.
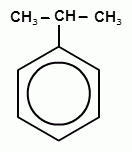
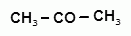 + О2 → +
+ О2 → +
Применение фенолов. Раствор фенола (карболовая кислота) -первый антисептик, введенный в хирургию. Двухатомные фенолы – пирокатехин, резорцин (см. начало лекции), а также гидрохинон (пара- дигидроксибензол) применяют как антисептики в медицине и ветеринарии (антибактериальные обеззараживающие вещества). В виде отдельных соединений фенолы используются ограниченно, зато их различные производные применяют широко. На основе фенолов получают многочисленные лекарственные препараты, например, аспирин, салол, фенолфталеин. Пирокатехин – структурный элемент многих БАВ, например, катехоламинов, его метиловый эфир (гваякол) – применяют для лечения верхних дыхательных путей. Кроме того, производные фенола используют как красители, парфюмерные продукты, пластификаторы для полимеров и средства защиты растений. Фенолы служат исходными соединениями для получения разнообразных полимерных продуктов – фенолоальдегидных смол, полиамидов, полиэпоксидов. Пирокатехин и резорцин вводят в состав дубителей для кожи и меха, используют как стабилизаторы смазочных масел и резины, а также для обработки фотоматериалов и как реагенты в аналитической химии. Конденсированные фенолы входят в состав нефти и каменного угля. Используют для получения многих лекарственных соединений. Нафтол – важная составная часть «молодой нефти» нафталана, которая используется для лечения заболеваний кожи, опорно-двигательного аппарата и т.д. Структура фенантрола лежит в основе строения холестерина и других стероидов в организме человека.
Поиск по сайту: