 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
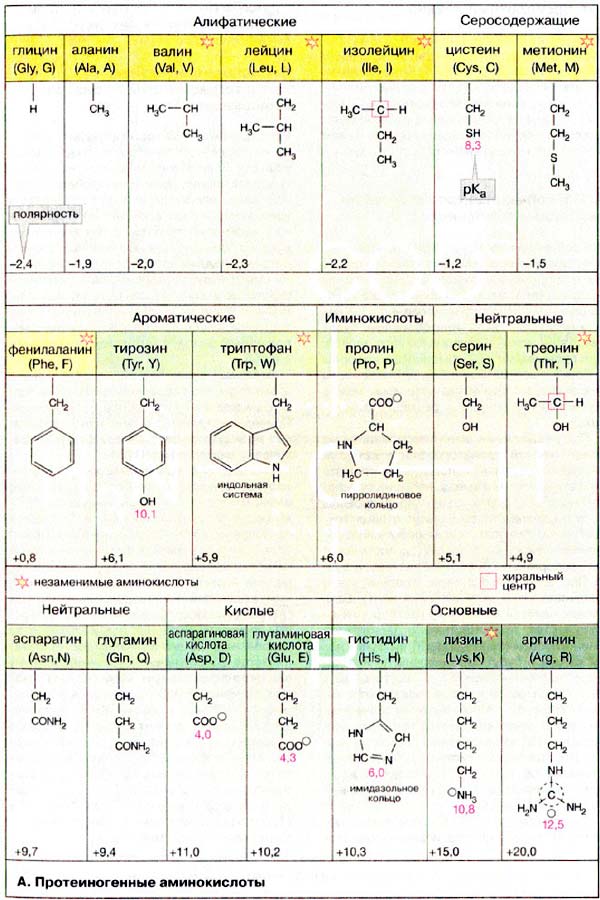
Протеиногенные аминокислоты
|
Читайте также: |
Тема: Аминокислоты. Пептиды. (2час)
План:
1.Протеиногенные аминокислоты.
2.Пептиды.
3.Белки.
Протеиногенные аминокислоты
Многообразные пептиды и белки состоят из аминокислот. Общее число встречающихся в природе аминокислот достигает 100, однако некоторые из них обнаружены в определенном сообществе организмов или даже в одном их виде. Известны 20 наиболее важных аминокислот, постоянно встречающихся во всех белках. (таблица «Протеиногенные аминокислоты»).
Общая формула аминокислот R - CH – COOH
Ì
NH2
-N H2 - аминогруппа;
-R- углеводородный радикал;
-COOH – карбоксильная группа.
Пептиды
Пептиды и белки́— высокомолекулярные азотсодержащие органические вещества, состоящие из альфа-аминокислот, связанных между собой пептидными связями. Пептиды принято делить на олигопептиды (в цепи не более 10 аминокислотных остатков) и полипептиды(в цепи до 100 аминокислотных остатков). Условно считают, что пептиды содержат в молекуле до 100, а белки - свыше 100 аминокислотных остатков. Полипептиды с молекулярными массами более 10 000 Да называют белками. Белки иначе называют протеинами; этот термин введен в 1838 году и образован от греч.слова proteos-первостепенный. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Белки при гидролизе распадаются до аминокислот. Элементарный состав белков: Углерод -50-55%, Водород -6,5-7,3%, Азот -15- 18%, Кислород -21-24%,Сера-2,4%, Зола-0,5%. Особенно характерный показатель - процентное содержание азота, в большинстве случаев оно составляет 16 %.
Протеиногенные аминокислоты
Определение аминокислотной последовательности первого белка — инсулина — принесло Фредерику Сенгеру Нобелевскую премию по химии в 1958 году. Инсулин состоит из двух цепей: А-21 аминокислотный остаток, - Б- 30 аминокислотных остатков. Инсулин регулирует углеводный обмен.

Структуру белковой молекулы объясняет полипептидная теория Э.Фишера (1902), который разработал метод связывания аминокислот друг с другом. Получающиеся при этом продукты были названы полипептидама. Схема этого процесса протекает по типу реакции поликонденсации(реакции образования полимерных соединений, сопровождающиеся выделением низкомолекулярного продукта, в данном случае–воды). Схематическое изображение образования пептидной связи. 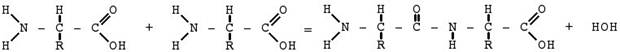
СОNH-пептидные (амидные) группы;
CH-метиновые группы;
R-боковые радикалы.
Молекулы белков представляют собой линейные полимеры, состоящие из α--аминокислот (которые являются мономерами). На первый взгляд может показаться, что использование в большинстве белков всего 20 видов аминокислот ограничивает разнообразие белковых структур, на самом деле количество вариантов трудно переоценить: цепочка из 100 аминокислот (небольшой белок) может быть представлена более чем в 10130 вариантах. При образовании белка в результате взаимодействия α-аминогруппы (-NH2) одной аминокислоты с α-карбоксильной группой (-COOH) другой аминокислоты образуются пептидные связи.Концы белка называют C- и N-концом (в зависимости от того, какая из групп концевой аминокислоты свободна:-COOH или -NH2, соответственно). При синтезе белка на рибосоме новые аминокислоты присоединяются к C-концу, поэтому название пептида или белкадаётся путём перечисления аминокислотных остатков начиная с N-конца.Последовательность аминокислот в белке соответствует информации,содержащейся в гене данного белка.

Первичная структура — последовательность аминокислот в полипептидной цепи. Первичная структура белка уникальна и детерминируется генами. Все белки отличаются по первичной структуре. Вторичная структура — под вторичной структурой белка понимают способ укладки полипептидной цепи в упорядоченную структуру. По конфигурации выделяют следующие элементы вторичной структуры: α-спираль и β-складчатый слой. Модель строения α-спирали, учитывающая все свойства пептидной связи, была разработана Л.Полингом и Р.Кори (1950.). Вторичная структура формируется и поддерживается водородными связями, возникающими между Н и О пептидных групп. Хотя энергия водородных связей мала, большое количество их приводит к значительному энергетическому эффекту, в результате чего вторичная структура довольно устойчива.
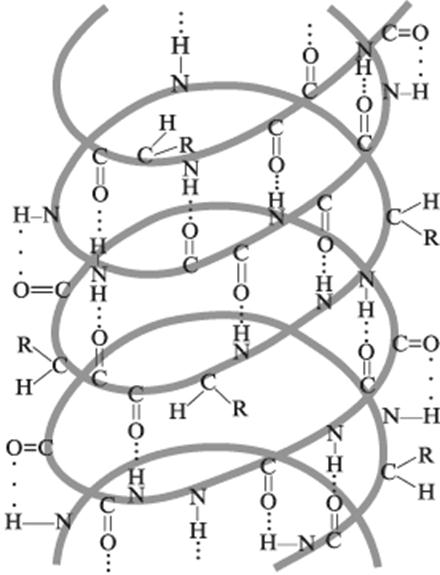
α-спирали — плотные витки вокруг длинной оси молекулы, витки спирали регулярные, один виток составляют 3,6 аминокислотных остатка, и расстояние между витками- шаг спирали составляет 0,54 нм (так что на один аминокислотный остаток приходится 0,15 нм),диаметр спирали составляет 0,5 нм, плоскости соседних пептидных групп находятся под углом 108 ®, спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Хотя спираль может быть как левозакрученной, так и правозакрученной, в природных белках преобладает правозакрученная. Угол подъема витка равен26 ®. Боковые радикалы аминокислотных остатков не участвуют в поддержании α-спиральной конфигурации, поэтому все аминокислотные остатки в α-спирали равнозначны.
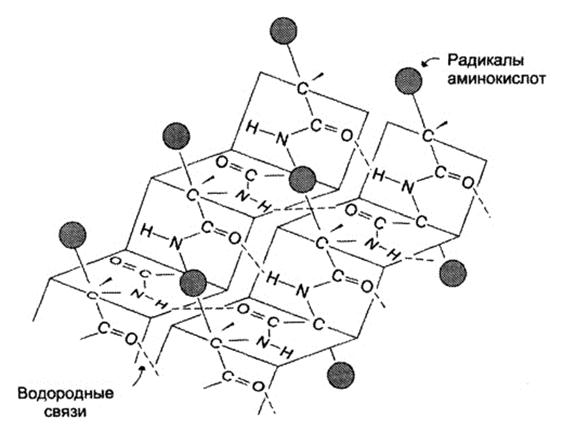

β-листы (складчатые слои) — второй элемент вторичной структуры, имеет линейную структуру, которая удерживается благодаря возникновению водородных связей между пептидными группировками, стоящими на разных участках полипептидной цепи, расстояние между которыми составляет 0,272 нм. Остов цепи не лежит в одной плоскости, а вследствие изгибов образует волнистый слой. Складчатые листы могут быть параллельны друг другу, направление от N-конца к С-концу одной цепи совпадает с N-C направлением другой цепи, или антипараллельны (N- и C-концы цепей противоположны). Вторичная структура определяетсяпервичной. Во многих белках одновременно имеются и α-спирали и β-слои. Так, гемоглобин и миоглобин спирализованы на 75%, а мышечный белок парамиозин-на 100%.Кератин (белок волос) и коллаген (белок кожи и сухожилий)-имеют β-конфигурацию.
 Третичная структура — это способ укладки полипептидной цепи в пространстве. Чтобы белок приобрел присущие ему функциональные свойства, полипептидная цепь должна определенным образом свернуться в пространстве, сформировав функционально активную структуру-сфункционально активным центром. Такая структура называется нативной. В стабилизации третичной структуры принимают участие:
Третичная структура — это способ укладки полипептидной цепи в пространстве. Чтобы белок приобрел присущие ему функциональные свойства, полипептидная цепь должна определенным образом свернуться в пространстве, сформировав функционально активную структуру-сфункционально активным центром. Такая структура называется нативной. В стабилизации третичной структуры принимают участие:
ковалентныесвязи (между двумя остатками цистеина — дисульфидные мостики); ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; водородные связи, возникающие между пептидными группами и функциональными группами боковых радикалов; гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы, а внутри –гидрофобные неполярные радикалы образуют «жирные капли» или «сухиезоны».Третичная структура отдельно взятого белка уникальна, как уникальна и его первичная структура. Различные нарушения третичной структуры приводят к изменению свойств белка и потере его биологической активности. 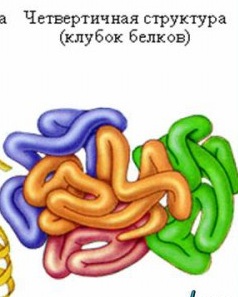
Четверичная структура (или субъединичная) — взаимное расположение нескольких полипептидных цепей (субъединиц) в составе единого белкового комплекса. В стабилизации четвертичной структуры принимают участие те же типы взаимодействий, что и в стабилизации третичной. Надмолекулярные белковые комплексы могут состоять из десятков молекул. Белок, обладающий четвертичной структурой, называется эпимолекулой или мультимером, а составляющие его полипептидные цепи соответственно субъединицами или протомерами. Классическим примером белка, имеющего четвертичную структуру, является гемоглобин.
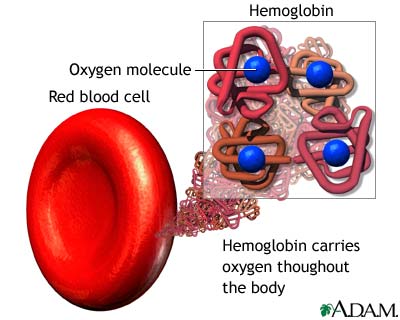
Молекула гемоглобина с молекулярной массой 68 000 Да состоит из четырех субъединиц двух разных типов –α-и β-. α-субъединица состоит из141 аминокислотного остатка, а β- из 146. Гемоглобин относится к глобулярным белкам, диаметр молекулы 5,5 нм. Третичная структура α- и β-субъединиц сходна, как и их молекулярная масса (17 000 Да). Изменение уникальной четвертичной, третичной, частично вторичной структуры белка называют денатурацией белка. Денатурированный белок теряет характерные для него свойства. Денатурацию можно вызвать действием концентрированных кислот, щелочей, высоких температур, механических воздействий, наличием ионов тяжелых металлов, действием УФ-светом или рентгеновскими лучами.

Самый известный случай денатурации белка в быту — это приготовление куриного яйца, когда под воздействием высокой температуры растворимый в воде прозрачный белок овальбумин становится плотным, нерастворимым и непрозрачным. Денатурация в некоторых случаях обратима, этот процесс называется ренатурация белка.
Номенклатура и классификация белков. Ввиду огромного числа белков, функционирующих в живых организмах(1,2×106видов, начиная от вирусов и заканчивая человеком) не существует единой их номенклатуры, как нет и единой классификации. Названия белкам дают по случайным признакам, чаще всего принимая во внимание источник выделения (липопротеин сывороточный), форму молекулы (фибриноген), аминокислотный состав и др.В настоящее время действует несколько классификаций, в основу каждой из них положен какой – либо признак, по которому белки объединяют в узкие или широкие группы. Белки классифицируют по степени сложности строения, по форме белковой молекулы, по отношению к условно выбранным растворителям, по выполняемым им функциям. Классификация по степени сложности строения
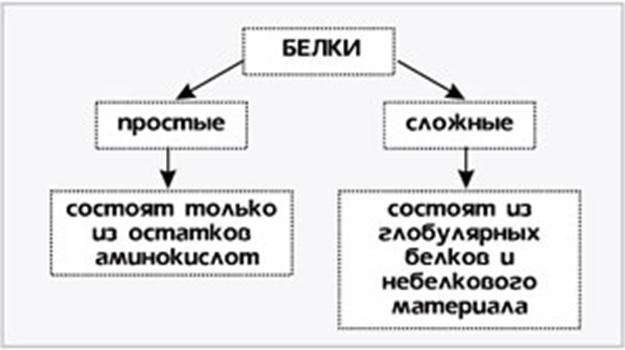
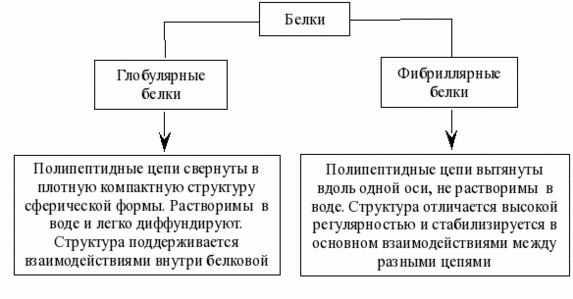
В состав многих белков помимо пептидных цепей входят и неаминокислотные фрагменты, по этому критерию белки делят на две большие группы — простые (протеины) и сложные белки (протеиды). Простые белки –однокомпонентные- содержат только аминокислотные цепи, сложные белки-двухкомпонентные- содержат также неаминокислотные фрагменты. Эти фрагменты небелковой природы в составе сложных белков называются «простетическими группами». Классификация по форме белковых молекул
Поиск по сайту: