 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Рефрактометрические методы анализа: основные закономерности и понятия
| Унитарное предприятие | Имущество находится | Создается по решению* | Ответственность предприятия |
| На праве хозяй-ственного ведения | В государственной или муниципальной собственности | Уполномоченного на то государственного (муниципального) органа | Собственник не отвечает по обязательствам предприятия |
| На праве опера-тивного управления (федеральное казенное предприятие) | В государственной собственности | Правительства РФ | Предприятие отвечает по своим обязательствам всем имуществом и не отвечает по обязате-льствам собственника |
| Субсидиарную ответ-ственность по обязате-льствам казенного предприятия несет РФ | |||
| * Этим же органом утверждается устав и назначается руководитель предприятия, подотчетный этому органу |
Рефрактометрические методы анализа: основные закономерности и понятия
Рефрактометрия является одним из старейших и наиболее часто употребляемых физических методов определения строения органических соединений. В настоящее время в связи с интенсивным развитием многих других современных физических методов исследования рефрактометрические методы значительно утратили свою былую ценность, но, тем не менее являются хорошими вспомогательными методами, которые помогают легко проверить правильность предположений о составе и строении органических молекул.
Рассмотрим основные физические закономерности, лежащие в основе рефрактометрического метода.
Если луч света пересекает границу раздела двух прозрачных однородных сред 1 и 2, то направление луча изменяется в соответствии с законом преломления, согласно которому, отношение синусов углов падения (i1) и преломления (i2) есть величина постоянная:

|
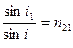
| Константа n 21 называется относительным показателем преломления второго вещества по отношению к первому. Показатель преломления вещества определяется его природой, но зависит также от внешних условий (главным образом от температуры) и от длины волны света. Длину волны указывают подстрочным индексом, а температуру − надстрочным индексом справа. Вместо длины волны |
часто употребляемых линий обычно указывают их буквенные обозначения. Например,  ,
,  и
и  обозначают показатели преломления при 20 °С для линии D натрия (5893 А) и линий С и F водорода (6563 и 4861 А).
обозначают показатели преломления при 20 °С для линии D натрия (5893 А) и линий С и F водорода (6563 и 4861 А).
Изменения плотности вещества всегда сопровождаются изменением его показателей преломления. Обычно при увеличении плотности увеличивается и показатель преломления. Существует прямо пропорциональная зависимость показателя преломления n от плотности d:
f(n) = r×d
Постоянный коэффициент r, характерный для данного вещества, называют удельной рефракцией. Величина удельной рефракции не зависит от внешних условий и агрегатного состояния вещества.
Величину удельной рефракции можно вычислить, используя формулу Лорентц-Лоренца:

Молекулярной рефракцией R называется произведение удельной рефракции на молекулярный вес М:
R = r×M
С учетом формулы Лорентц-Лоренца, получаем:

Молекулярная рефракция является мерой поляризуемости молекул. В электромагнитном поле видимого света поляризуемость молекулы практически целиком обусловлена смещением электронов и равна сумме эффектов смещений отдельных электронов. Это означает, что величина молекулярной рефракции является аддитивной. Аддитивность молекулярной рефракции органических соединений широко используется для определения их состава и строения.
Зависимость показателей преломления от длины волны называется дисперсией света или рефракционной дисперсией. В качестве меры дисперсии часто употребляется разность показателей преломления для двух длин волн nl1−nl2, называемая частной дисперсией. Частная дисперсия для спектральных линий С и F, охватывающих среднюю часть видимого спектра, называется средней дисперсией nF−nC. Для удобства эту величину часто умножают на 104 и обозначают D FC:

Родственной константой является относительная дисперсия:
 или
или 
Относительная дисперсия также обладает свойством аддитивности. В органической химии в качестве меры дисперсии используется так называемая молекулярная дисперсия, представляющая собой разность молекулярных рефракций для двух длин волн:
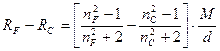
Аддитивность этой величины также позволяет использовать ее для определения строения органических соединений.
Рассмотрим применение этих величин для определения строения органических соединений.
В середине XIX в. вскоре после установления понятия о гомологическом ряде Бертло выявил простое соотношение между молекулярными рефракциями соседних членов гомологического ряда:

Согласно этому уравнению, молекулярную рефракцию n -ного члена гомологического ряда можно рассматривать как сумму молекулярных рефракций первого члена R1 и n-1 групп CH2:
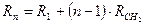
Позже данные Бертло были подтверждены большим числом примеров. Это дало основание полагать, что молекулярная рефракция, по крайней мере, для некоторых групп соединений, зависит только от природы и числа атомов в молекулах и может быть вычислена суммированием характерных для данного элемента констант − атомных рефракций:

Однако для некоторых соединений величина молекулярной рефракции, рассчитанная по данной аддитивной схеме, не совпадала с экспериментальной. Простейшими из таких соединений являлись этиленовые углеводороды и их производные. Тем не менее и этот класс соединений удалось вписать в аддитивную схему, приписав каждой двойной связи С=С особую постоянную: инкремент молекулярной рефракции двойной связи. Прибавляя этот инкремент двойной связи к сумме атомных рефракций, получали хорошее соответствие с экспериментальными значениями молекулярной рефракции. Для ацетиленовых соединений был установлен аналогичный инкремент тройной связи.
Таким образом, установление влияния природы связей на молекулярную рефракцию имело весьма большое значение, так как открывало возможность использования молекулярной рефракции для определения строения органических соединений.
В сложных функциональных группах с многовалентными элементами невозможно достаточно строго определить атомные рефракции по аддитивной схеме без условных допущений. Поэтому наряду с атомными рефракциями и инкрементами стали употребляться групповые рефракции радикалов.
В начале XX в. было выяснено, что значения молекулярной рефракции определяются главным образом числом и свойствами валентных электронов, участвующих в образовании химических связей. В связи с этим было решено видоизменить аддитивную схему и рассматривать молекулярную рефракцию как сумму рефракций связей.
Между атомными рефракциями, инкрементами и рефракциями связей существуют простые, чисто алгебраические соотношения. Например, молекулярная рефракция метана согласно аддитивной схемы равна сумме атомных рефракций или же сумме рефракций четырех связей С−Н, т.е.:

Отсюда получаем: 
При увеличении состава на группу СН2 происходит увеличение молекулярной рефракции на  и одновременное увеличение числа связей на одну связь С−С и две С−Н. Следовательно:
и одновременное увеличение числа связей на одну связь С−С и две С−Н. Следовательно:

С учетом молекулярной рефракции связи С−Н можно получить:

Таким же образом, рассматривая молекулярную рефракцию этиленовых и ацетиленовых углеводородов, можно вывести соотношения между рефракциями двойной и тройной С−С-связей и соответствующими инкрементами системы атомных рефракций:


Способ расчета по рефракциям связей более последователен, он проще и точнее передает соотношение между аддитивной схемой и современными структурными формулами. Однако при установлении строения соединений до сих пор используются как рефракции связей, так и атомные рефракции.
При установлении особых инкрементов двойной и тройной связей было замечено, что не все непредельные соединения укладываются в аддитивную схему. Особенно большие расхождения между фактическими и аддитивными значениями молекулярной рефракции наблюдались у некоторых веществ с двумя или более кратными связями С=С, СºС, С=О и т.д.
Разницу между экспериментальными и вычисленными по аддитивной схеме значениями молекулярной рефракции называют экзальтацией молекулярной рефракции и обозначают символом ЕМ:
ЕМ = Rэксп − Rадд
Величина экзальтации зависит от длины волны света, поэтому ее часто указывают подстрочным индексом.
Чаще всего величины экзальтации положительны, но в ряде случаев могут быть и отрицательными, тогда идет речь о депрессии молекулярной рефракции.
Исследование непредельных соединений показало, что особенно большие экзальтации наблюдаются при наличии систем сопряженных кратных связей. Значительные экзальтации наблюдаются также, если кратные связи находятся в сопряженном положении к бензольным кольцам, как например, в стироле, фенилацетилене и др.
Экзальтацию молекулярной рефракции обнаруживают и ароматические соединения с несколькими непосредственно соединенными или конденсированными бензольными кольцами (ряды дифенила, нафталина, антрацена и т.д.).
Молекулярная рефракция бензола и его гомологов довольно точно соответствует вычисляемой по аддитивной схеме согласно формуле Кекуле, хотя наличие трех сопряженных двойных связей в открытой цепи приводит к весьма высоким экзальтациям. Кумулированные двойные связи в алленовых и подобных им структурах также обычно не показывают экзальтаций.
Гетероциклические сопряженные системы, такие как фурановая, пиррольная и тиофеновая, обнаруживают депрессию молекулярной рефракции − значительные отклонения от аддитивности.
Одна из главных причин отклонений от аддитивности заключается в несовершенстве и упрошенном характере самой аддитивной схемы.
Поиск по сайту: