 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Строение
|
Читайте также: |
Простейший представитель алкинов (этиновых или ацетиленовых углеводородов) – ацетилен СНºСН.
В молекуле содержится две одинарные связи С-Н и одна тройная связь СºС.
Тройная связь состоит из сигма - и двух пи -связей.
Углерод находится в состоянии sp-гибридизации.
 Следовательно, у каждого атома углерода есть по две sp-гибридные орбитали, которые лежат в одной плоскости и перекрываются, образуя s-скелет молекулы.
Следовательно, у каждого атома углерода есть по две sp-гибридные орбитали, которые лежат в одной плоскости и перекрываются, образуя s-скелет молекулы.
Они расположены под углом 180о.
У одного атома углерода их два, у двух атомов – четыре.
Две sp-орбитали перекрываются с s-орбиталями атомов водорода, образуя сигма -связи: С-Н малополярная ковалентная связь, С-С – неполярная ковалентная связь. Это перекрывание с образованием сигма -связей происходит в одной плоскости.
Форма молекулы – линейная. Валентный угол 180о.
У каждого атома углерода осталось по две негибридных р-орбитали, которые имеют форму симметричной объемной «восьмерки».
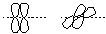 Они расположены перпендикулярно линии (оси) сигма -скелета.
Они расположены перпендикулярно линии (оси) сигма -скелета.
Перекрываются над и под линией; спереди и сзади линии.
Так образуется две пи -связи.
 Итак, тройная углерод-углеродная СºС связь:
Итак, тройная углерод-углеродная СºС связь:
- ковалентная
- неполярная
- одна сигма -, две другие пи -
- сигма-связь прочная, с трудом поляризуемая
- пи-связь менее прочная, легко поляризуемая
- энергия СºС связи равна 812 кДж/моль (прочнее, чем одинарная и двойная)
- длина СºС связи равна 0,120 нм (короче, чем одинарная и двойная).
Следовательно, алкины, содержащие слабые пи -связи, будут склонны к их разрыву (гомолитическому или гетеролитическому) с присоединением различных реагентов (симметричных – Н2, Сl2, I2, HOOH, N2O4 или несимметричных – HOH, HCl, HBr, и др.). Может присоединяться как один моль реагента (разрыв одной пи-связи), так и двух реагентов (избыточное присоединение, разрыв двух пи-связей). Высокая реакционная способность фрагмента СºС объясняет также склонность алкинов к окислению (в отличие от алканов, даже в мягких условиях).Кроме того, связь С-Н при тройной связи (-СºС-Н) поляризована от Н к С, склонна к гетеролитическому разрыву, подвижный Н (слабые кислотные свойства) способен замещаться на металл (образование ацетиленидов) и отщепляться, присоединяясь (по группе С=О) к альдегидам и кетонам (конденсация).
Поиск по сайту: