 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Практична частина
Кафедра хімії та ХТНР
Лабораторна робота №3
з курсу Фізична хімія
| Журнал прийняв: _ доцент Солодовнік Т.В. “___”_____________20__р. | Журнал оформив: студент групи “___”_____________20__р |
Черкаси, 20__.
Лабораторна робота №2
Тема: Термодинаміка хімічної рівноваги
Мета роботи: Виміряти тиск дисоціації при температурах 900С, 1000С, 1100С і обчислити Кр для цих температур. Обчислити зміну ентропії реакції. Зробити висновки про напрямок зміщення рівноваги в системі при зміні температури та тиску.
Теоретична частина.
Можливість самочинного перебігу хімічної реакції визначається знаком зміни ізобарно-ізотермічного потенціалу (енергія Гіббса) DGт. Для реакції типу:
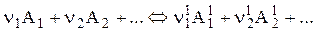 (1)
(1)
при сталому тиску та температурі DGт визначають за рівнянням ізотерми реакції:
 (2)
(2)
де: nі - стехіометричний коефіцієнт і -го учасника реакції;
аі - активність і -го учасника реакції у вихідному стані, моль/м3;
lnК - логарифм константи рівноваги при даній температурі.
Якщo DGт < 0, самочинно протікатиме пряма реакція, апри DGт > 0 - зворотна. ЯкщоDGт = 0 швидкості прямої і зворотної реакцій однакові. За стандартних умов, коли активності всіх учасників реакції дорівнюють одиниці, між константою рівноваги реакції і величиною DGт існує залежність:
DGт = -RT × lnKa(3)
або для ідеальних газових систем:
DGт = -RT × lnKp (4)
Якщо величина Ka або Кp визначена експериментальне, то, інтегруючи рівняння ізобари:
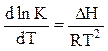 (5)
(5)
де: DН - зміна ентальпії реакції, Дж/моль
R - універсальна газова стала, 8.З14 Дж/моль×К
Т - температура, К
від К1 при Т1 до К2 при Т2, припустивши незалежність DН від Т (що справедливо для вузького температурного інтервалу) одержимо:
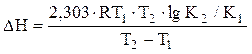 (6)
(6)
Зміна ентальпії пов'язана зі зміною ізобарно-ізотермічного потенціалу рівняннями другого закону термодинаміки:
DH = DG + TDS (7)
де: DS - зміна ентропії реакції, Дж/моль×К
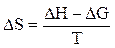 ( 8 )
( 8 )
Практична частина.
Визначення тиску дисоціації у системі при різних температурах.
Термічна дисоціація гідрокарбонату натрію.
Гідрокарбонат натрію NaHCO3 при температурі понад 700С розкладається з виділенням CO2 і H2О. Якщо розклад солі відбувається у замкнутому об'ємі, то в системі встановлюється рівновага:
2NaHCO3 Û Na2CO3 + CO2 + H2O
Оскільки активності кристалічних речовин за визначенням дорівнюють одиниці
a(NaHCO3) = a(Na2CO3) = 1,
то Кр = Р(СО2) × Р(Н2О)
Загальний тиск виділених у реакції газів називається тиском дисоціації. Вимірявши його, можна обчислити парціальні тиски та константу рівноваги:
Рд = Р(СО2) + Р(Н2О)
Р(СО2) = Р(Н2О) = ½ Рд
Кр = (½ Рд)2
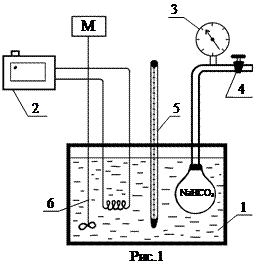 Установка (рис.1) складається з гліцеринового нагрівника (1), інтенсивність нагріву якого регулюється ЛАТР-ом ( 2 ), колби з гідрокарбонатом, зануреної в нагрівник і приєднаної до вакуумметра (3). Система може сполучатись з атмосферою або приєднуватися до вакуум-насосу через кран (4), вимірювання температури здійснюється ртутним термометром(5), мішалка (6) забезпечує рівномірність обігріву. Для вимірювання тиску дисоціації слід занурити колбу з гідрокарбонатом у гліцерин, приєднати насос і ретельно викачати повітря із системи.
Установка (рис.1) складається з гліцеринового нагрівника (1), інтенсивність нагріву якого регулюється ЛАТР-ом ( 2 ), колби з гідрокарбонатом, зануреної в нагрівник і приєднаної до вакуумметра (3). Система може сполучатись з атмосферою або приєднуватися до вакуум-насосу через кран (4), вимірювання температури здійснюється ртутним термометром(5), мішалка (6) забезпечує рівномірність обігріву. Для вимірювання тиску дисоціації слід занурити колбу з гідрокарбонатом у гліцерин, приєднати насос і ретельно викачати повітря із системи.
Необхідно підключити установку до електромережі, увімкнути її, встановити стрілку вольтметра на ЛАТР-і на поділку 200В, підігріти до 800С. Потім зменшити напругу до 50-70В і домогтись підтримання заданої температури з точністю ±10С, змінюючи напругу на нагрівнику в невеликих межах. Подальше завдання полягає у підтриманні заданої температури.
Після встановлення в системі рівноваги, про що свідчитимуть сталі покази вакуумметра, записати значення тиску та температури. Тиск дисоціації дорівнює:
Рд = Рб – Рв (9)
де Рд - тиск дисоціації, Па
Рб - покази барометра х 133.3, Па
Рв - покази вакуумметра х 9.8 × 104, Па
Поиск по сайту: