 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Карно циклі
Негізінен жылу машиналары Карно циклімен жұмыс атқарады. Карно циклі 2 изотермадан және 2 адиабатадан тұрады.
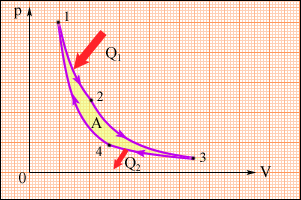
1) 1 – 2 – изотермиялық ұлғаю.
2) 2 – 3 – адиабаталық ұлғаю.
3) 3 – 4 – изотермиялық сығылу.
4) 4 – 1 – адиабаталық сығылу.
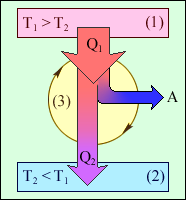
Карно циклімен жұмыс кез-келген жұмыс машинасы температурасы Т1 қыздырғыштан (1), жұмыс денесінен (3) және температурасы Т2 салқындатқыштан (2) тұрады (сурет).
Бір циклде жұмыс денесі қыздырғыштан Q1 жылу мөлшерін алады, салқындатқышқа Q2 жылу мөлшері береді және сыртқы денелермен А жұмыс атқарады.
 .
.
Кез-келген қондырғының тиімділігі - пайдалы әсер коэффициентімен анықталады.
 .
.
Жылу машинасының пайдалы әсер коэффициенті бір цикл кезінде атқарылған пайдалы жұмысының қыздырғыштан алынған жылу мөлшеріне қатынасына тең болады.
11.3.Энтропия
Термодинамикалық жүйенің күйін анықтайтын шаманың бірі энтропия болып табылады. Энтропия зат молекулаларының қозғалысының тәртіпсіздігінің мөлшері болып табылады. Өлшем бірлігі 
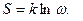
мұндағы:  - күй ықтималдығы.
- күй ықтималдығы.
 .
.
Қайтымды тұйық процесте энтропиялық өзгерісі нольге тең.
Кез-келген жылу машинаның пайдалы әсер коэффициенті идеал жылу машинаның пайдалы әсер коэффициентінен үлкен болмайды.
Идеал жылу машинаның пайдалы әсер коэффициенті

Идеал жылу машинаның пайдалы әсер коэффициенті тек қыздырғыш пен салқындатқыштың температурасына тәуелді.
Термодинамиканың екінші заңы:
1. Сыртқы ортада ешқандай өзгеріс болмаған жағдайда ешқашан салқын денеден ыстық денеге жылу берілмейді.
2. Дененің ішкі энергиясының есебінен шексіз жұмыс атқару мүмкін емес.  .
.
3. Кез-келген процестерде жүйенің энтропиясы кемімейді.

Термодинамиканың үшінші заңы (Нернст теоремасы)
 .
.
Абсолют нольде термодинамикалық жүйенің энтропиясы нольге тең болады.
§12.Тасымалдау құбылыстары
Жүйенің тепе-теңдік күйі бұзылғанда жүретін құбылыстарды зерттейтін ғылым физикалық кинетика деп аталады.
Тепе-теңдік күйі бұзылғанда газдарда жылудың немесе қозғалыс мөлшерінің ағыны пайда болады. Сондықтан осындай құбылыстарды тасымалдау құбылыстары деп атайды.
Тасымалдау құбылыстарының келесі үш түрі кездеседі: диффузия, жылу өткізгіштік және ішкі үйкеліс (тұтқырлық).
Жылу өткізгіштік құбылысы ортаның әр түрлі нүктелерінің температуралары әр түрлі болғанда жүреді және ортаның температурасы үлкен бөлігінен кіші бөлігіне жылу тасымалданады. Жылу ағыны дегеніміз белгілі бір беттен бірлік уақытта тасымалданатын жылу мөлшері болып табылады.
Газдарда жылу берілу: конвекция және жылу өткізгіштік, жылулық сәуле берілу арқылы болады.
Газдардың жылу өткізгіштігі газ молекулаларының жылулық қозғалысына байланысты жүреді. Жылдамдығы жоғары молекулалардың жылдамдығы төмен молекулалармен үздіксіз араласу нәтижесінде газдың бір қабатынан екінші температурасы төмен қабатына жылу тасымалданады.
1) Диффузия деп - әр түрлі қоспалардың молекулаларының жылулық қозғалыстың нәтижесінде өздігінен бір-бірімен араласып орналасуын айтамыз. Диффузия кезінде газдың І көлемінен ІІ көлеміне зат тасымалданады.
2) Жылу өткізгіштік құбылысы кезінде газдың температурасы жоғарғы көлемінен температурасы төмен көлемге энергия тасымалдайды.
3) Ішкі үйкеліс кезінде газдың бір қабатынан екінші қабатына импульс тасымалданады.
Диффузия кезінде масса, жылу өткізгіштік кезінде энергия, ішкі үйкеліс кезінде импульс тасымалданады. Содықтан бұл құбылыстар тасымалдау құбылыстары деп аталады.
Газ молекуласының еркін жолының ұзындығы:
Газ молекуласының көршілес екі соқтығысу арасында жүріп өткен ара қашықтығын газ молекуласының еркін жолының ұзындығы деп атайды. Өлшем бірлігі  .
.

мұндағы: z –1 секундтағы соқтығу саны
 ,
,
 .
.
Газ молекуласының соқтығысу кезіндегі центрлерінің бір-біріне жақындайтын ең аз ара қашықтығын газ молекуласының эффективтік диаметрі деп атайды.
 - газ молекуласының эффективті қимасы,
- газ молекуласының эффективті қимасы, 

мұндағы: 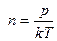 екенін ескерсек
екенін ескерсек
 .
.
Газ молекуласының еркін жолының орташа ұзындығы абсолют температура тура пропорционал және газдың қысымына кері пропорционал.
12.1.Диффузия құбылысы
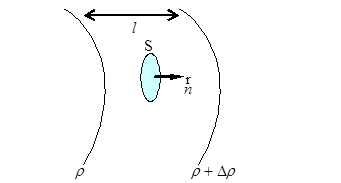
| Диффузия құбылысы кезінде заттың бір көлемінен екінші көлеміне зат тасымалданады.
 - тығыздық градиенті.
Тығыздық градиенті деп белгілі бағытта тығыздықтың өзгеру шапшаңдығын айтады. - тығыздық градиенті.
Тығыздық градиенті деп белгілі бағытта тығыздықтың өзгеру шапшаңдығын айтады.
|
Диффузия құбылысын сипаттайтын заңды Швейцар физигі Фик ашты. Сондықтан бұл заң Фик заңы деп аталады:
Диффузия құбылысы кезінде  аудан арқылы t уақытта тасымалданатын зат массасы тығыздық градиентіне тура пропорционал болады.
аудан арқылы t уақытта тасымалданатын зат массасы тығыздық градиентіне тура пропорционал болады.

мұндағы:  - диффузия коэффициенті, өлшем бірлігі
- диффузия коэффициенті, өлшем бірлігі 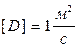 .
.
12.2.Жылу өткізгіштік құбылысы
Жылу өткізгіштік кезінде заттың бір көлемінен екінші көлеміне энергия тасымалданады.
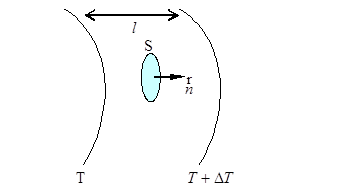
|  - температура градиенті.
Температура градиенті деп белгілі бағытта температураның өзгеру шапшаңдығын айтады.
Жылу өткізгіштік құбылысын сипаттайтын заңды француз ғалымы Фурье ашты. - температура градиенті.
Температура градиенті деп белгілі бағытта температураның өзгеру шапшаңдығын айтады.
Жылу өткізгіштік құбылысын сипаттайтын заңды француз ғалымы Фурье ашты.
|
Сондықтан бұл заң Фурье заңы деп аталады:
Жылу өткізгіштік құбылысы кезінде  аудан арқылы t уақытта тасымалданатын жылу мөлшері температура градиентіне тура пропорционал болады.
аудан арқылы t уақытта тасымалданатын жылу мөлшері температура градиентіне тура пропорционал болады.

 ,
,
мұндағы:  - жылу өткізгіштік коэффициенті, өлшем бірлігі
- жылу өткізгіштік коэффициенті, өлшем бірлігі  .
.
12.3.Ішкі үйкеліс құбылысы
Сұйық немесе газ қабаттары бір-біріне қатысты қозғалған жағдайда олардың арасында үйкеліс күші пайда болады. Бұл құбылыс ішкі үйкеліс құбылысы деп аталады.

| Ішкі үйкеліс кезінде газдың бір қабатынан екінші қабатына импульс (қозғалыс мөлшері) тасымалданады.
 - жылдамдық градиенті.
Ішкі үйкеліс құбылысын сипаттайтын заңды ағылшын - жылдамдық градиенті.
Ішкі үйкеліс құбылысын сипаттайтын заңды ағылшын
|
ғалымы Ньютон ашты. Сондықтан бұл заң ішкі үйкеліс құбылысы үшін Ньютон заңы деп аталады:
 немесе
немесе 
мұндағы:  -кернеу,
-кернеу, 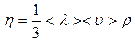 -ішкі үйкеліс коэффициенті немесе тұтқырлық, өлшем бірлігі
-ішкі үйкеліс коэффициенті немесе тұтқырлық, өлшем бірлігі 
§ 13.Нақты газдар
Менделеев-Клапейрон теңдеуі молекулалары бір-бірімен әсерлеспейтін және нүкте деп қарастырылатын идеал газдардың күйін анықтайды. Нақты газдардың молекуларының өлшемдері болады және олар бір-бірімен өзара әсерлеседі. Нақты газдардың күйін анықтайтын теңдеуді алу үшін голланд ғалымы Ван-дер-Ваальс Менделеев-Клапейрон теңдеуіне молекулаларды өлшемдерін және өзара әсерлесуін ескеретін түзету енгізді. Бұл алынған теңдеу нақты газдардың күй теңдеуі немесе Ван-дер-Ваальс теңдеуі деп аталады. Мөлшері 1 моль нақты газ үшін Ван-дер-Ваальс теңдеуі келесі түрде жазылады:
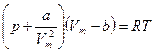 ,
,
мұндағы:  -Ван-дер-Ваальс тұрақтылары, өлшем бірліктері
-Ван-дер-Ваальс тұрақтылары, өлшем бірліктері 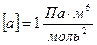 ,
,  .
.
Бірінші жақша ішіндегі  түзетуі молекулалардың арасындағы тартылыс күшінің әсерінен пайда болады. Оны кейде ішкі қысым деп атайды.
түзетуі молекулалардың арасындағы тартылыс күшінің әсерінен пайда болады. Оны кейде ішкі қысым деп атайды.  түзетуі молекулалардың өлшемдерін ескереді. Кез-келген мөлшердегі нақты газ үшін Ван-дер-Ваальс теңдеуі
түзетуі молекулалардың өлшемдерін ескереді. Кез-келген мөлшердегі нақты газ үшін Ван-дер-Ваальс теңдеуі 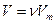 екенін ескере отырып келесі түрде жазылады:
екенін ескере отырып келесі түрде жазылады:
 немесе
немесе 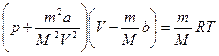 .
.
Нақты газдардың ішкі энергиясы  өрнегімен анықталады, мұндағы
өрнегімен анықталады, мұндағы  - молекулалардың қосынды кинетикалық энергиясы,
- молекулалардың қосынды кинетикалық энергиясы,  -молекулалардың қосынды өзара әсерлесу энергиясы.
-молекулалардың қосынды өзара әсерлесу энергиясы.  энергиясын анықтайық. Ол үшін молекулалардың арасындағы тартылу күшінің жұмысы
энергиясын анықтайық. Ол үшін молекулалардың арасындағы тартылу күшінің жұмысы  энергиясының кемуіне тең екенін ескереміз, яғни
энергиясының кемуіне тең екенін ескереміз, яғни  . Молекулалардың арасындағы тартылу күші
. Молекулалардың арасындағы тартылу күші 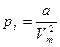 ішкі қысыммен сипатталады. Сондықтан
ішкі қысыммен сипатталады. Сондықтан  және
және  .
.
Молекулалардың қосынды  кинетикалық энергиясы олардың қозғалысына тәуелді болады.
кинетикалық энергиясы олардың қозғалысына тәуелді болады.
Сондықтан Ван-дер-Ваальс газының 1 молінің ішкі энергиясы
 ,
,
мұндағы: 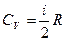 .
.
Поиск по сайту: