 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Взаимодействие гормона с мембранным рецептором, передача сигнала

|
Связывание гормона рецептором происходит на внешней стороне клеточной мембраны. Для дальнейшего переноса индуцируемого сигнала, направленного на внутриклеточные регуляторные процессы, необходим механизм, локализованный в клеточной мембране. В трансмембранной передаче гормонального сигнала должен участвовать целый ряд компонентов. Согласно гипотезе Rodbell (см. рис. 1, 3), гормон Г связывается с рецептором Р во внешнем слое мембраны. Этот гормонрецепторный комплекс взаимодействует с нуклеотидзависимым компонентом НС, который расположен во внутреннем слое и активируется гуанилнуклеотидом (ГТФ) и двухвалентными ионами. Затем Р-НС- комплекс, в свою очередь, взаимодействует с каталитической компонентой КС (она идентична аденилатциклазе). Аденилатциклаза активируется и катализирует синтез циклического аденозинмонофосфата (цАМФ).
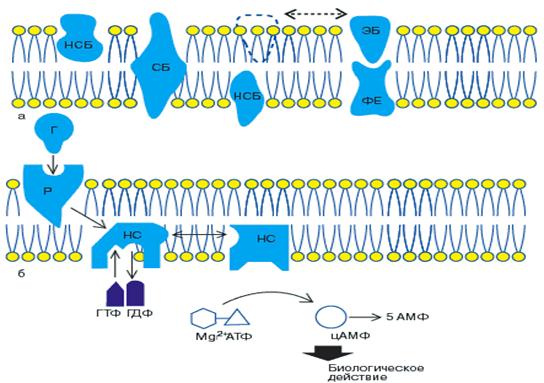
Рис. 1. а) Жидкостно-мозаичная модель мембраны клетки (по Singer, Nicolson, 1972). Белки распределены между двумя слоями липидной мембраны и расположены таким образом, что у одних белков гидрофильная часть находится вне липидного слоя (СБ — стягивающие белки), у других — внутри липидного слоя (НСБ — нестягивающие белки). Поскольку НСБ двигаются свободно, эффекторный белок (ЭБ) наружного слоя может реагировать с ферментной единицей (ФЕ) внутреннего слоя и таким образом передавать сигнал с поверхности клетки внутрь клетки,
б) Модель активации аденилатциклазы гормоном (Roclbell, 1980). Г — гормон; Р — рецептор; НС — нуклео-тидрегулирующая субъединица; КС — каталитическая субъединица (аденилатциклаза).
Согласно приведенной гипотезе, молекулы белка способны двигаться в жидком матриксе мембраны клетки (гипотеза лабильных рецепторов рис. 3). И действительно, в клеточную мембрану, не содержащую рецепторов можно встроить как сами рецепторы, так и Р-НС-комплекс; при этом сохраняется последовательность процессов активации гормонами. Предполагают, что по аналогии с димерной структурой рецептора упомянутые выше НС- и КС - субъединицы существуют в виде димеров. Кроме того, доказано, что НС-и КС-субъединицы являются общей эффекторной системой ряда гормонов. В исследованиях на тканях крыс обнаружены два типа НС - субъединиц, одна из которых стимулирует, а другая ингибирует каталитическую субъединицу. На рис. 2 схематически показана такая возможность для жировой ткани человека.
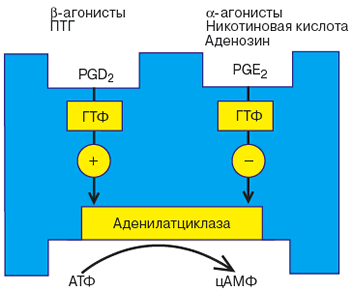
Рис. 2. Механизмы стимуляции и ингибирования аденилатциклазной системы
в жировой ткани (по Coppper и соавт., 1979.)

Рис. 3. Опосредованное через протеинкиназу действие
системы вторых посредников на клетку
Открытие аденилатциклазы и цАМФ, образование которого катализируется этим ферментом, было сделано при исследовании гликогенолитического действия адреналина и глюкагона на клетки печени. Эти опыты привели Сазерленда к гипотезе двух посредников (или двухэтапной гипотезе). Согласно ей первый этап запускается сигналом, который вызывается гормоном. После селективного связывания гормона с мембранным рецептором по уже описанному механизму в клетке-мишени происходит активация аденилатциклазы (первый посредник), что в свою очередь приводит к образованию цАМФ (внутриклеточный переносчик сигнала — второй посредник) из АТФ. цАМФ запускает вторую ступень, что выражается в активации протеинкиназы, катализирующей фосфорилирование регуляторных клеточных белков в различных местах клетки, включая ядро. Всем этим запускается целый каскад специфических внутриклеточных реакций (активирование и инактивирование ферментов, изменение мембранных белков и проницаемости мембран, транспорта ионов, обмена углеводов, влияние на экспрессию генов, т. е. транскрипционные и посттранскрипционные процессы, а также синтез белков, РНК, ДНК, рост клетки и ее деление), что в итоге и составляет специфическое воздействие гормона. Наряду с активацией протеинкиназ цАМФ контролирует активность и других ферментов (например, фосфофруктокиназы, ДНК-зависимой полимеразы и т. д.). Во время реализации биологического каскада происходит значительное усиление гормонального сигнала, первоначально возникающего на клеточной поверхности, что может объяснять исключительную эффективность гормонов в пределах очень низких концентраций. Фактическое содержание цАМФ в клетке определяется скоростью его синтеза и расщепления, причем превращение цАМФ в 5' - АМФ катализируется фосфодиэстеразой. Именно благодаря этому процессу временно повышенный уровень цАМФ после контакта гормона с клеткой очень быстро возвращается к исходному.

|
Для большого числа пептидных или гликопептидных гормонов (АКТГ, ХГ, ФСГ, ЛГ человека, липотропного гормона, меланофорстимулирующего гормона, паратгормона, ТТГ, вазопрессина, фактора роста нервов, глюкагона, ТРГ, ЛГ- РГ), катехоламинов и простагландина E1, связывание с рецептором приводит к активации клетки и, следовательно, к выработке цАМФ. В табл. 1 приведен ряд гормональных воздействий, индуцирующих синтез цАМФ.
Таблица 1. Примеры действия гормонов с участием цАМФ
| Ткань-мишень | Действующий гормон | Действие, опосредованное цАМФ |
| Гипофиз | ТРГ, ЛГ- РГ | Синтез и выброс ТТГ, пролактина, ФСГ и ЛГ |
| Щитовидная железа | ТТГ | Синтез гормонов щитовидной железы (экзоцитоз, пиноцитоз, перемещение лизосом, протеолиз тиреоглобулина в фаголизосомах, экскреция Т3 и Т4) |
| -Клетки поджелудочной железы | Глюкагон | Выброс инсулина |
| Надпочечники | АКТГ | Синтез глюкокортикоидов |
| Яичники | ЛГ, ФСГ Катехоламины Простагландин Е | Синтез овариальных стероидов |
| Яички Клетки Лейдига Клетки Сертоли | ЛГ ФСГ | Синтез тестикулярных стероидов Синтез андрогенсвязывающего белка |
| Печень | Глюкагон Катехоламины | Гликогенолиз глюконеогенез |
| Почки Дистальные канальцы Проксимальные канальцы | Антидиуретический гормон Паратгормон | Проницаемость воды Реабсорбция кальция, магния, выделение фосфора |
| Жировая ткань | Катехоламины Глюкагон АКТГ Секретин | Липолиз |
| Мускулатура матки | Окситоцин Вазопрессин Серотонин (3-адренергические амины, простагландины Е и F | Сократимость мускулатуры матки |
| Скелетные мышцы | Катехоламины | Гликогенолиз |
| Мышца сердца | Катехоламины Глюкагон | Гликогенолиз увеличение сократимости |
| Кости | Паратгормон | Экскреция кальция н фосфата |
Независимо от изменения числа мембранных рецепторов при избытке гормона ткани-мишени могут стать нечувствительными (пострецепторное-уменьшение чувствительности ткани). Это описано для АКТГ, ТТГ, ЛГ и инсулина. В качестве примера можно привести ЛГ и его рецепторы в гонадах, когда при наличии рецепторов ЛГ система аденилатциклаза — цАМФ не реагирует на гормон. Блокирование образования цАМФ избытком гормона является, очевидно, вторым защитным механизмом, гарантирующим надежность биологических систем.

|
Другие гормоны, такие как -адренергические катехоламины и их агонисты, ангиотензин, человеческий плацентарный лактоген, эпидермальный фактор роста, фактор роста фибробластов, соматотропин, инсулин, инсулиноподобный фактор роста, стимулятор активности деления, окситоцин, пролактин, Простагландин F2a, соматомедин и соматостатин, не стимулируют аденилатциклазу после связывания с рецептором. Ацетилхолин, окситоцин, -адренергические Катехоламины (но не пролактин и инсулин) стимулируют образование внутри клетки циклического гуанозинмонофосфата (цГМФ) — нуклеотида, сходного по строению с цАМФ. Подобно цАМФ в некоторых клетках цГМФ стимулирует фосфорилирование белков, но в других клетках этот посредник является антагонистом цАМФ. Последним объясняются те случаи, когда гормон может действовать одновременно и как антагонист на одну и ту же клетку-мишень. Для инсулина и пролактина известен не совсем обычный механизм, когда на втором этапе гормонального воздействия видимо принимает участие специфический белок.
Как уже упоминалось, особое значение для рецепторного связывания имеет концентрация Са2+ в клетке. Рецептор действует как ионофор. Связывание гормона приводит к конформационным изменениям белков клеточной мембраны и как следствие к образованию (открытию) каналов для ионов, которые однако остаются открытыми короткое время. Поступивший в клетку Са2+связывается со специфическим белком (кальмодулином), который считается особым внутриклеточным регулятором. Повышение концентрации Са2+ в клетке приводит к активации гуанилциклазы и, соответственно, к образованию цГМФ. Кроме того, ионы Са2+могут влиять на фосфорилирование белков через кальцийзависимые протеинкиназы.
Связывание гормона может выглядеть как простая обратимая реакция R+H > RH, KD = [R][H] / [RH], где [R] и [H]. концентрации свободного рецептора и гормона (лиганда), соответственно, и [RH] - концентрация комплекса рецептор-гормон. KD, константа диссоциации комплекса рецептор- лиганд, характеризует сродство рецептора к лиганду. Уравнение связывания можно дополнить: [RH] / RT = 1 / (1 + KD / [H]) где RT. сумма свободных и связанных рецепторов: [R] + [RH]. Уравнение подобно уравнению Михаэлиса-Ментен, используемому для анализа ферментативных реакций. Более низкому значению KD соответствует более высокое сродство рецептора к его лиганду. Значение KD эквивалентно концентрации лиганда, при которой половина рецепторов связана с лигандом. Как правило, число рецепторов в суспензии клеток или их фрагментов определяют по связыванию с содержащим радиоактивную метку гормоном. Для многих рецепторов, взаимодействующих с гормонами, концентрация лиганда, необходимого для генерации максимального клеточного ответа, меньше значения, необходимого для насыщения всех рецепторных молекул клетки
Поиск по сайту: