 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Особенности репликации ДНК эукариот
ДНК у эукариот не кольцевая. Тогда возникает вопрос: как же достигается плавление ori?
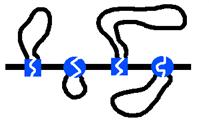
| У фага Т4 тоже не кольцевая ДНК. Субъединицы гиразы сближают несмежные участки ДНК и образуется петля. В ней и ведется суперспирализация. | |

| У эукариот ДНК закрепляется белками в нескольких местах на ядерной мембране. На каждом отдельном участке работает топоизомераза. Сколько участков, столько и ori. | |
Хотя в клетке у человека ДНК на 3 порядка больше чем у E. сoli, время репликации соизмеримо (за счет большего количества ori).
Каждая эукариотическая хромосома - полирепликон.
| Определение: репликон - участок ДНК между двумя ori. | 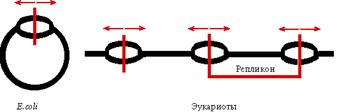
|
Размер фрагментов Оказаки у эукариот меньше (200-400 нукл).
Скорость работы ДНК-полимераз эукариот на порядок ниже, чем у прокариот.
| Организм | Количество репликонов | Средний размер репликона, тыс.п.н. | Скорость движения репликативной вилки п.н./мин. |
| E.сoli | |||
| Дрожжи | |||
| Дрозофила | |||
| Ксенопус (лягушка) | |||
| Мышь | |||
| Бобы |
У эукариот РНК-затравки размером 6-10 нукл. удаляются РНК-азой Н (hybrid). Бреши заделываются репарирующими ферментами.
Проблема репликации концов линейных молекул
Модель "заячьи уши".  Работает у ряда вирусов
Работает у ряда вирусов
Репликация концов ДНК хромосом эукариот
Удаление РНК-праймеров после завершения синтеза линейных ДНК в виде фрагментов Оказаки и заделывание образующихся между фрагментами брешей нуклеотидами ДНК приводит к тому, что дочерние цепи ДНК оказываются короче материнских на размер первого РНК-праймера (10-20 нукл.).
Образуются 3'-оверхенги, т.е. выступающие 3'-концы материнских цепей. Они узнаются теломеразой - ферментом, содержащим помимо белковой части еще и РНК, выполняющую роль матрицы для наращивания ДНК повторами.
Теломераза последовательно наращивает материнские цепи ДНК повторами, используя 3'-оверхенги в качестве затравок. Образующиеся длинные одноцепочечные концы в свою очередь служат матрицами для синтеза дочерних цепей традиционным репликативным механизмом.

|
Хромосомы соматических клеток человека фланкированы многократно повторенными гексамерами TTAГГГ, общая длина районов с повторами может достигать 10 тыс. пар нуклеотидов. В комплексе со специфическими белками такие тандемные повторы образуют теломеры, защищающие концы ДНК от действия экзонуклеаз, предотвращающие неправильную рекомбинацию и позволяющие концам хромосом прикрепляться к ядерной оболочке.
При каждом раунде репликации происходит укорочение теломер в среднем на 50 пар нуклеотидов. Поскольку теломерные последовательности не являются кодирующими, они выступают в роли буферной зоны - как защита от "проблемы концевой репликации".
Укорочение ДНК в ходе каждого раунда репликации лишь сокращает нетранскрибируемый текст теломеры, но не приводит к утрате смысловых последовательностей - генов и регуляторов их экспрессии.
Регуляция репликации прокариот известна, т.к. известны гены белков регуляции репликации E.сoli и механизмы их включения (выключения). Для эукариот эти механизмы еще не ясны, но известно расписание репликации ДНК по разным хромосомам.
Причины ошибок при синтезе ДНК
Способность ошибаться заложена в самой структуре фермента.
Скорее всего, ферменты, которые не ошибались, были тупиковыми ветвями эволюции. На первых этапах зарождения жизни разнообразие обеспечивалось только такими ошибками.
In vitro происходит 1 ошибка на 100 тыс. нукл. для средней ДНК-полимеразы.
In vitro можно уменьшить вероятность ошибки до 1 на 1млн. нукл., если добавить SSB, геликазу и лигазу.
Можно и увеличить вероятность ошибки до 1 на 100, если дать неадекватное количество субстрата, а также если добавить ионы серебра, бериллия, меди, кобальта, никеля, свинца. Это происходит из-за конкуренции этих ионов с ионами магния за связывание с ДНК-полимеразой.
Еще один способ повышения количества ошибок - добавление аналогов нуклеотидов. Например бромдезоксиуридина - аналога тимидина.
Это одно из средств борьбы со СПИДом и раком. Аналоги одинаково вредны для всех клеток, однако в пораженных вирусом клетках чаще проходит репликация.
Этапы проверки
Первичный отбор нуклеотидов идет по принципу комплементарности.
Способностью к этому виду отбора обладают все ДНК-полимеразы благодаря полимеризационной 5'  3' активности.
3' активности.
Редактирующий отбор.
Его проводят все полимеразы благодаря экзонуклеазной активности 3'  5'.
5'.
Исправление ошибок в уже синтезированной ДНК.
Этим занимаются ферменты репарации.
Вероятность ошибок для ферментов вирусов, про- и эукариот
| Объект | Вероятность замены на пару оснований |
| E.coli | 2х10-10 |
| Дрозофила | 5х10-11 |
| Фаг Т4 | 2х10-8 |
Разницу связывают со скоростью работы фермента. Чем медленней, тем точнее!
Лекция 8. Синтез белка в клетке. Подготовительный этап. Структура рибосом.
Рекогниция
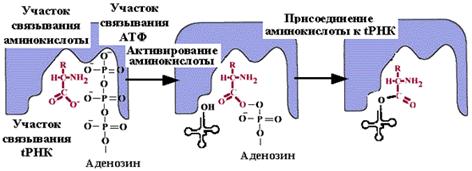
Определение: рекогниция - это подготовительный этап трансляции, суть которого в образовании ковалентной связи между tРНК и соответствующей аминокислотой.
Состоит из двух стадий:
1. Активирование аминокислоты.
2. Присоединение аминокислоты к tРНК - аминоацилирование.
Обе стадии рекогниции осуществляются ферментом аминоацил-tРНК-синтетазой (APC-азой, кодазой). Существует 20 вариантов кодаз (по числу аминокислот). У каждой кодазы 3 центра опознавания. Каждая АРС-аза узнает третичную структуру tРНК.
|
Определение: tРНК, имеющие разную первичную, но одинаковую третичную структуру, акцептируют одну и ту же аминокислоту и называются изоакцепторными tРНК.
| Есть особая tРНК, которая называется формилметиониновой tРНК. Она узнается метиониновой кодазой, соединяется с метионином и уже после реакции аминоацилирования метионин формилируется специальным ферментом, который узнает эту особую форму tРНК. Именно с формилметионина начинается синтез любого полипептида у прокариот. | 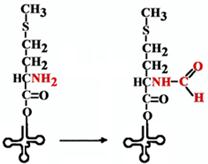
|
Определение: аминоацилирование - это образование связи между аминокислотой и tPHК.
Следующий этап трансляции - собственно синтез полипептидов, происходит на рибосомах.
Структура рибосом
Рибосомы - немембранные самые мелкие клеточные органеллы, при этом они едва ли не самые сложные. В клетке E. сoli присутствует около 103-5х103 рибосом. Линейные размеры прокариотической рибосомы 210 х 290 Å. У эукариот - 220 х 320 Å.
Выделяют четыре класса рибосом:
1. Прокариотические 70S.
2. Эукариотические 80S.
3. Р ибосомы митохондрий (55S - у животных, 75S - у грибов).
4. Рибосомы хлоропластов (70S у высших растений).
Определение: S - коэффициент седиментации или константа Сведберга. Отражает скорость осаждения молекул или их компонентов при центрифугировании, зависящую от конформации и молекулярного веса.
Каждая рибосома состоит из 2-х субъединиц (большой и малой).
| Прокариотическая рибосома | Эукариотическая рибосома | ||
| 70S | 80S | ||
| 50S | 30S | 60S | 40S |
| 5S rРНК 23S rРНК | 16S rРНК | 5S rРНК 5.8S rРНК 28S rРНК | 18S rРНК |
| 34 молекулы белков, из них 31 разные | 21 белок | не менее 50 разных белков | не менее 33 разных белков |
Сложность объясняется тем, что все элементы рибосом представлены в одном экземпляре, за исключением одного белка, присутствующего в 4 копиях в 50S субъединице, и не могут быть заменены.
rРНК выполняют не только функцию каркасов субъединиц рибосом, но и принимают непосредственное участие в синтезе полипептидов.
23S rРНК входит в каталитический пептидилтрансферазный центр, 16S rРНК необходима для установки на 30S субъединице инициирующего кодона mРНК, 5S rРНК - для правильной ориентации аминоацил-tРНК на рибосоме.
Все rРНК обладают развитой вторичной структурой: около 70% нуклеотидов собрано в шпильки.
rРНК в значительной степени метилированы (СН3-группа во втором положении рибозы, а также в азотистых основаниях).
Порядок сборки субъединиц из rРНК и белков строго определен. Субъединицы, не соединенные друг с другом, представляют собой диссоциированные рибосомы. Соединенные - ассоциированные рибосомы. Для ассоциации нужны не только конформационные изменения, но и ионы магния Mg2+ (до 2х103 ионов на рибосому). Магний нужен для компенсации отрицательного заряда rРНК. Все реакции матричного синтеза (репликация, транскрипция и трансляция) связаны с ионами магния Mg2+ (в меньшей степени - марганца Mn2+).
Каталитические центры рибосом
| Асп - центр специфического узнавания. Здесь происходит взаимодействие кодон-антикодон. Р-центр - пептидильный, донорный. Он является донором формилметионина при инициации, или пептидила при элонгации трансляции. А-центр - аминоацильный, акцепторный. Акцептирует формилметионин в самом начале или пептидил при элонгации трансляции. К-центр - каталитический (фермент пептидилтрансфераза). В К-центре задействована 23S rРНК и несколько белков большой субъединицы. | 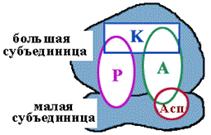
|
Синтез белка в клетке состоит из двух этапов: рекогниции и собственно синтеза полипептида на рибосоме. Ключевым субстратом рекогниции является транспортная РНК.
Структура транспортной РНК
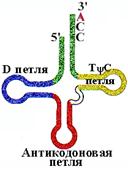
Транспортные РНК (tРНК) - короткие молекулы (70-90 нукл.), имеющие и вторичную, и третичную структуру.
Вторичная структура - "клеверный лист". Последовательность CCA на 3'-конце одинакова для всех tРНК. К концевому аденозину (А) присоединяется аминокислота.
Наличие в tРНК тимина (T), псевдоуридина(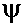 ) (в T ) (в T 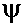 C- петле), и дигидроуридина (ДГУ) (в D-петле) - минорных, т.е. редко встречающихся в РНК нуклеотидов, указывает на особенности ее строения, необходимые для безошибочного узнавания ферментами, для защиты от действия рибонуклеаз (поэтому tРНК - долгоживущие, в отличие от mРНК). C- петле), и дигидроуридина (ДГУ) (в D-петле) - минорных, т.е. редко встречающихся в РНК нуклеотидов, указывает на особенности ее строения, необходимые для безошибочного узнавания ферментами, для защиты от действия рибонуклеаз (поэтому tРНК - долгоживущие, в отличие от mРНК).
| 
|
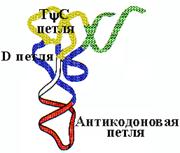
| Третичная структура в проекции на плоскость имеет форму бумеранга. Разнообразие первичных структур tРНК - 61+1 - по количеству кодонов (соответственно числу антикодонов в tРНК) + формилметиониновая tРНК, у которой антикодон такой же, как у метиониновой tРНК. Разнообразие третичных структур - 20 (по количеству аминокислот). |
Синтез полипептидов на рибосоме
У прокариот перед каждым геном и соответственно в mРНК перед копией каждого гена имеется лидерная последовательность.
| Она может быть разного размера (до 160 нукл.) и разной первичной структуры, но обязательно содержит полипуриновую последовательность Шайна-Дальгарно, которая комплементарна 3'-концевому участку 16S rРНК. Комплементарными могут быть 3-9 нуклеотидов. | 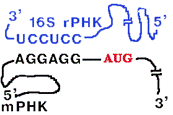
|
Назначение комплементарного взаимодействия 3'-концевого участка 16S rРНК и последовательности Шайна-Дальгарно - правильная установка инициирующего кодона AUG на малой субъединице рибосомы.
Инициирующий кодон находится на растоянии 3-10 нукл. от последовательности Шайна-Дальгарно.
| К малой субъединице, на которой уже находится mРНК, подходит формилметиониновая tРНК, соединенная с формилметионином. В результате образуется инициаторный комплекс: 30S субъединица рибосомы + mРНК + формилметионовая tРНК-формилметионин. Затем происходит ассоциация рибосомы. При этом изменяется конформация 16S rРНК и нарушается связь между ней и последовательностью Шайна-Дальгарно. | 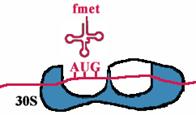
| |||

| Аминоацильный конец формилметиониновой tРНК оказывается в Р-центре. Второй кодон гена оказывается в Асп-центре. Соответствующая ему аминоацил-tРНК устанавливается таким образом, что ее аминоацильный конец попадает в А-центр. | |||

| Пептидилтрансфераза отрывает формилметионин в Р-центре и переносит его в А-центр. Образуется пептидная связь между формилметионином и аминоацил-tРНК. | |||

| Рибосома претерпевает конформационные изменения и сдвигается на один кодон. Формилметиониновая tРНК покидает рибосому. Второй кодон оказывается напротив Р-центра. Сюда же переходит tРНК, несущая на хвосте дипептид. В Асп-центр попадает третий кодон, а в А-центр очередная аминоацил-tРНК. | |||
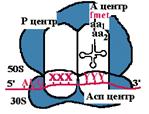
| Теперь в Р-центре отрывается дипептид, переносится в А-центр и соединяется с третьей аминоацил-tРНК. Так продолжается до тех пор, пока в Асп-центр не приходит терминирующий кодон. Полипептид отрывается в Р-центре, переносится в А-центр и, т.к. присоединиться ему не к чему, он отваливается от рибосомы. Рибосома диссоциирует и малая субъединица сканирует mРНК. | |||
In vivo на каждой стадии (образования инициаторного комплекса, инициации, элонгации и терминации) участвуют различные белковые факторы, которые препятствуют посадке на рибосому деацилированных tРНК или запрещают посадку формилметиониновой-tРНК в А-центр.
На всех этапах принимают участие молекулы ГТФ, которые дефосфорилируются.
Смысл гидролиза ГТФ не в отдаче энергии, а в свидетельстве того, что данный этап трансляции пройден.
| Все синтезируемые полипептиды прокариот на N-конце несут формилметионин. В 20% случаев он отщепляется, а в 80% отщепляется только формильная группа и на N конце остается метионин. | 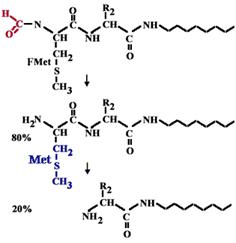
|
Регуляция образования рибосомных РНК и белков рибосом E.сoli
Ежеминутно в E.сoli образуется около 500 рибосом.
Имеется 7 оперонов, в которых закодированы rРНК (всего 3 разных rРНК х 7оперонов = 21 ген). В формировании рибосом участвуют 52 различных белка, а значит 52 гена, их кодирующих. В итоге,
73 гена должны работать координированно, чтобы не было избытка белков или rРНК.
Вначале образуется про-rРНК, которая метилируется и процессируется (т.е. "созревает").

|
Количество rРНК регулируется количеством рибосомных оперонов, скоростью их транскрипции и работой ферментов метилаз и эндонуклеаз.
Имеется 7 разных оперонов, в которых закодированы рибосомные белки. Регуляция каждого из них осуществляется отдельно.
 -оперон регулируется белком S4.
-оперон регулируется белком S4.
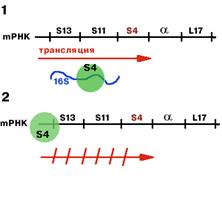
| Если в клетке имеется свободная 16S rРНК, то S4 связывется с ней (1). Если же 16S rРНК не хватает, то он связывается с mРНК, считывающейся с данного оперона (2). Причем связывается в районе лидера и тем самым мешает трансляции. |
Таким образом, осуществляется регуляция на уровне трансляции.
Оперон S10 регулируется белком L4.
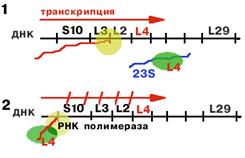
| РНК-полимераза синтезирует первую лидерную последовательность, длиной 140 нукл. Если 23S rРНК не хватает (2), то белку L4 не с чем соединяться, и он взаимодействует с лидерной последовательностью, придавая ей такую конформацию, которая не позволяет РНК-полимеразе продолжать транскрипцию. В результате синтез mРНК обрывается на первом же лидере (2). |
Регуляция на уровне транскрипции.
Оперон  .
. 
В этом опероне закодированы белки, имеющие принципиальное значение для инициации транскрипции ( - фактор), инициации репликации (dna G - праймаза) и инициации трансляции (белок S21). Каждый белок нужен в разном количестве. S21 ~ 50000 копий, dnaG ~ 50,
- фактор), инициации репликации (dna G - праймаза) и инициации трансляции (белок S21). Каждый белок нужен в разном количестве. S21 ~ 50000 копий, dnaG ~ 50,  - фактор ~ 5000. Между геном S21 и геном dnaG есть слабый терминатор транскрипции. Ген dnaG имеет инициирующий кодон ГУГ (а не АУГ), который гораздо хуже узнается рибосомой и реже, чем АУГ инициирует трансляцию.
- фактор ~ 5000. Между геном S21 и геном dnaG есть слабый терминатор транскрипции. Ген dnaG имеет инициирующий кодон ГУГ (а не АУГ), который гораздо хуже узнается рибосомой и реже, чем АУГ инициирует трансляцию.
Аттенуация (ослабление)
Рассмотрим систему аттенуации на примере триптофанового оперона E.сoli.
Этот оперон регулируется по схеме негативной репрессии.
При недостатке в клетке триптофана оперон открыт. При увеличении концентрации триптофана РНК-полимераза не доходит даже до первого цистрона.
Между оператором и первым цистроном есть протяженный участок (162 п.н.), который содержит последовательность Шайна-Дальгарно. Она расположена ближе к цистрону, все остальное же представляет собой аттенуатор.
В этом районе происходит прекращение транскрипции и отсоединение РНК-полимеразы от ДНК. Это сделано для того, чтобы остановить РНК-полимеразу, которая уже в пути, в том случае, если концентрация триптофана в клетке к этому моменту повысилась.

| В аттенуаторе выделяют 4 последовательности, частично комплементарные друг другу. В последовательности 1 закодирован 14-и членный пептид (Met-Lys-Ala-Ile-Phe-Val-Leu-Lys-Gly-Trp-Trp-Arg-Thr-Ser). На 10-ом и 11-ом месте в нем стоит триптофан. | |
| Если триптофан в клетке есть и доступен, то рибосома с легкостью преодолевает участок 1 и стерически мешает образованию шпильки (2)-(3). Тогда образуется шпилька (3)-(4), которая узнается РНК-полимеразой как сигнал прекращения транскрипции. Синтез mРНК обрывается. | 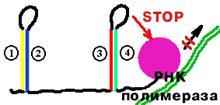
| |

| Если триптофан недоступен, то рибосома застревает на участке 1 и образуется шпилька (2)-(3). В этом случае не может образоваться шпилька (3)-(4). Сигнала для прекращения синтеза mРНК нет. |
Лекция 9. Основные репарабельные повреждения в ДНК и принципы их устранения
1. Апуринизация.
Каждая соматическая клетка теряет за сутки около 10000 пуринов и пиримидинов. В ДНК образуются АП-сайты.
Причины апуринизации:
изменение рН, ионизирующее излучение, повышение температуры и т.д.
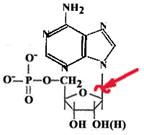
| Разрывается N-гликозидная связь между пуриновым основанием и дезоксирибозой. Если бы апуриновые участки не исправлялись, то была бы катастрофа. |
Пиримидины тоже могут отщепляться, но скорость этого процесса на два порядка ниже.
2. Дезаминирование.
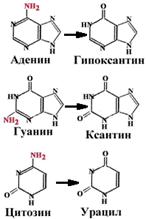
| Аденин превращается в гипоксантин, который образует две водородные связи с цитозином. Гуанин превращается в ксантин, который образует водородные связи с тимином. При дезаминировании цитозина образуется урацил. Тимин не может быть дезаминирован (единственный в ДНК). |
Наличие тимина в ДНК (вместо урацила) позволяет отличать дезаминированнный цитозин (т.е. урацил) от законного урацила, если бы он был в ДНК.
N-гликозилаза - фермент, который узнает дезаминированное основание, разрывает N-гликозидную связь и удаляет неправильное основание.
После этого АП-специфическая эндонуклеаза вносит одноцепочечный разрыв, и фосфодиэстераза отщепляет от ДНК ту сахарофосфатную группу, к которой теперь не присоединено основание. Появляется брешь размером в один нуклеотид.
У E. coli она заделывается ДНК-полимеразой I, а лигаза сшивает концы ДНК.
У эукариот брешь заделывает ДНК- полимераза  .
.
ДНК - двуцепочечна в отличие от РНК. Наличие второй цепи обеспечивает исправление ошибок. Дезоксирибоза более устойчива, чем рибоза, к действию щелочи, т.е. при рН > 8, ДНК устойчива, а РНК- нет.
3. Тиминовые димеры.

| Под действием ультрафиолетого света происходит ковалентное сшивание рядом стоящих пиримидинов. При сшивании тиминов образуется циклобутановое производное, блокирующее репликацию. |
Фермент фотолиаза - узнает тиминовые димеры и на свету или в темноте образует с ними комплекс. При освещении видимым светом происходит активация фермента, циклобутановое кольцо разрывается, и вновь получаются два тимина. Этот процесс называется фотореактивацией.
И дезаминированные основания, и тиминовые димеры, кроме того, могут удаляться с помощью эксцизионной репарации.
Специфические эндонуклеазы производят одноцепочечные разрезы (инцизия). Затем происходит удаление (эксцизия) нескольких нуклеотидов и заделывание бреши. У E. сoli заделыванием бреши занимается ДНК-полимераза I. Лигаза сшивает цепь. Она же ликвидирует одноцепочечные разрывы, возникающие при действии ионизирующей радиации.

| У E.coli эксцизионная репарация осуществляется мультиферментным комплексом, включающим белки uvrA, uvrB, uvrC (ultraviolet repair), которые узнают поврежденный участок и вносят 5'- и 3'- разрывы с разных сторон от него, uvrD - геликазу, которая отсоединяет вырезанный олигомер - 12 нуклеотидов, используя энергию АТФ. У эукариот существует функциональный (но не структурный) аналог такого мультиферментативного комплекса. |
О-6-метилгуанинтрансфераза - Фермент-"самоубийца".
Имеется 14 позиций, по которым ДНК метелируется.
| Гуанин может быть метилирован (по кислороду в 6-ом положении) и в такой форме будет связываться не только с цитозином, но и с тимином. Таким образом, в два шага может произойти замена пары Г-Ц на А-Т. Фермент принимает метильную группу на один из 12 цистеиновых остатков и при этом "гибнет". | 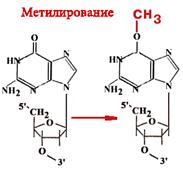
|
Лекция 10. Структура генома
Определение: геном - вся совокупность молекул ДНК клетки (в случае ряда вирусов говорят о геномной РНК).
Существует ядерный геном, митохондриальный геном и геном пластид. Мы будем рассматривать только ядерный геном. Соматические клетки содержат диплоидный (2n) геном, половые - гаплоидный (n).
Размер генома
| Объект | Размер гаплоидного генома в парах нуклеотидов |
| Микоплазмы | 104-106 |
| Эубактерии (E.coli) | 105-107 |
| Грибы | (2-5)х107 |
| Водоросли | (5-7)х107 |
| Черви | ~108 |
| Моллюски | 5х108-5х109 |
| Насекомые | 108-5х109 |
| Ракообразные | ~ 109 |
| Иглокожие | 2х108-2х109 |
| Рыбы | 3х108-1010 |
| Амфибии | 7х108-7х1010 |
| Рептилии | (2-3)х109 |
| Птицы | 109 |
| Млекопитающие | 3х109 |
| Цветковые растения | 2х108-1011 |
Прямой корреляции между количеством ДНК и эволюционной продвинутостью организма нет.
Так, например, у малярийного плазмодия 0.06 пг ДНК в ядре, а у амебы 490 пг. Большое количество ДНК не обязательно приносит качественно новую информацию. Амеба пошла на увеличение количества ДНК для увеличения размеров ядра и самой клетки. Генов у нее меньше, чем у плазмодия, но они копированы много раз. У малярийного плазмодия генов больше, чем у амебы, а ДНК меньше для максимальной компактности. Малые размеры ядра и самого одноклеточного организма позволяют ему быть внутриклеточным паразитом.
У африканской двоякодышащей рыбы ДНК в 15 раз, а у амебы в 70 раз больше, чем у человека.
"Избыточность" эукариотического генома
На ~ 106 пар нуклеотидов у бактерий приходится ~5 тыс. генов. На ~109 пар нуклеотидов у млекопитающих ~50 тыс. генов.
Минусы "избыточной" ДНК:
- увеличение времени синтеза ДНК;
- cложнее организовывать удвоение ДНК;
- высокая энергоемкость - на 1 нуклеотид для включения в цепь ДНК нужно затратить ~60 молекул АТФ.
Неопределенное следствие:
- благодаря зависимости размера ядра от количества ДНК происходит увеличение размеров клетки.
Плюсы "избыточной" ДНК:
- возникает возможность создания сложного регуляторного аппарата, позволяющего поднять организм на более высокий эволюционный уровень.
Причины избыточности:
1. Большой размер генов (за счет наличия интронов).
2. Присутствие повторенных последовательностей.
Повторяются и гены, и некодирующие участки. У эукариот некоторые последовательности повторены сотни и тысячи раз.
3. Наличие большого числа некодирующих последовательностей, часть из которых выполняет регуляторную функцию при транскрипции, а часть - необходима для компактизации генома.
Компактность генома эукариот
Компактность - другое принципиальное отличие генома эукариот от прокариотического генома.
При средней разнице размеров геномов на 3 порядка, линейные размеры эукариотических хромосом соизмеримы с длиной ДНК прокариот.
Выделяют, по крайней мере, 4 уровня компактизации ДНК. При этом нить ДНК "укорачивается" в 10000 раз.
Это все равно, что нить, длиной с Останкинскую башню (500 м), уложить в спичечный коробок (5см).
Два первых уровня компактизации эукариотического генома обеспечиваются гистонами.
Общая характеристика гистонов
Гистоны - осн о вные белки.
Все они обогащены лизином и аргинином - положительно заряженными аминокислотами.
Выделяют 5 фракций гистонов.
Нарабатывается их очень много - 60 млн. молекул каждой фракции на клетку.
| Фракция | Лизин | Аргинин | лиз./арг | осн.АК/кис.АК | Мол. вес (Да) |
| Н1 (очень богатая лизином) | 29% | 1% | >20 | 5.4 | |
| Н2В (умернно богатая лизином) | 16% | 6% | ~2.5 | 1.7 | |
| Н2А (умеренно богатая лизином и аргинином) | 11% | 9% | ~1 | 1.4 | |
| Н4 (богатая аргинином и глицином) | 11% | 14% | ~0.8 | 2.5 | |
| Н3 (очень богатая аргинином); в ней есть цистеин, а в других - нет | 10% | 13% | ~0.7 | 1.8 |
Все гистоны, кроме Н1, черезвычайно консервативны в эволюционном отношении (у коровы и клевера разница в Н2А всего в одну аминокислоту!).
Следовательно, эти белки выполняют принципиальную функцию, которая у всех эукариот обеспечивается одинаково.
Любая мутация в гистоновых генах летальна.
Н1 - очень вариабельная фракция. Этот гистон различен не только у видов, но даже у одного организма, в зависимости от стадий онтогенеза.
В гистонах лизин и аргинин кластированы. Средняя часть гистона содержит гидрофобные аминокислоты.
Положительно заряженные аминокислоты гистонов обеспечивают электростатические взаимодействия с ДНК.
Центральная часть необходима для взаимодействия гистонов между собой.
Четыре уровня компактизации ДНК
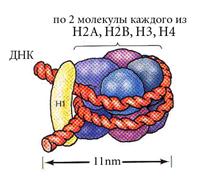
1. Нуклеосомный.

| В основе нуклеосомы лежит гистоновый октамер. Расположение гистонов не случайно. Каждая молекула представлена дважды. Они образуют кор (серцевину) нуклеосомы. На кор наматывается ДНК - 1.75 левых витка спирали. |
Определение: нуклеосомой называется повторяющийся структурный элемент хроматина, содержащий гистоновый октамер и ~180 п.н. ДНК.
| Непосредственно с октамером контактирует 145 п.н. и 20-30-40 п.н. между нуклеосомными корами. Нуклеосомный уровень упаковки свойственен всей эукариотической ДНК, он дает укорочение в 7 раз. Диаметр увеличивается с 20 Å до 110 Å. |
Гистоновые октамеры "скользят" по ДНК.
При репликации снимается и этот уровень компактизации. При транскрипции нуклеосомы сохраняются.
2. Супербидный, или соленоидный.
Фактически обеспечивается Н1 гистоном.
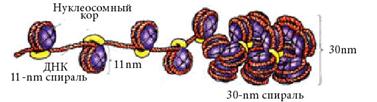
| Н1 взаимодействует с октамерами, сближает их, и еще на него наматывется ДНК. Образуется супербид. |
Происходит сокращение линейного размера ДНК в 6-10 раз. Диаметр увеличивается до 300Å.
Этот уровень компактизации, как и первый, не зависит от первичной структуры ДНК.
3. Петлевой уровень.
| Обеспечивается негистоновыми белками. Они узнают определенные последовательности ДНК и связываются с ними и друг другом, образуя петли по 20-80 тыс. п.н. | 
|
Петля обеспечивает экспрессию гена, т.е петля является не только структурным, но и функциональным образованием.
Есть участки, в которых нет петель.Укорочение за счет петель проходит в 20-30 раз. Образуются и петлевые домены. Диаметр увеличивается до 700Å.
4. Метафазная хромосома.

| Метафазная хромосома уже удвоена. Она состоит из двух хроматид. Каждая из них содержит одну молекулу ДНК. |
Сюда входят белки ядерной ламины, серия белковых нитей, сопряженных с ядерной оболочкой и пронизывающих все ядро.
Модификации гистонов очень сильно влияют на компактизацию ДНК.
Гистоны могут метилироваться, фосфорилироваться (по серину, треонину, тирозину), т.е. аминокислотные остатки легко модифицируются. Кроме того, возможно алкилирование и ацетилирование гистонов.
Геном высших эукариот А-Т типа (пары А-Т преобладают), низших эукариот - Г-Ц типа. У человека соотношение (Г+Ц)/(А+Т) = 0.45. У разных типов бактерий диапазон соотношения А-Т пар и Г-Ц пар велик.
Чем больше в геноме А-Т пар, тем больше возможностей для изменения вторичной структуры ДНК. При суперспирализации ДНК А-Т богатые участки плавятся в первую очередь.
| Классификация генов в геноме |
Основы метода ренатурации ДНК
ДНК обрабатывают ультразвуком. При этом она деградирует на двуцепочечные куски одинакового размера.
Затем смесь денатурируют и медленно охлаждают.
При температуре на 20  С ниже, чем температура плавления ДНК, идет восстановление вторичной структуры (ренатурация).
С ниже, чем температура плавления ДНК, идет восстановление вторичной структуры (ренатурация).
Если последовательности часто встречаются, то они ренатурируют быстрее.
В процессе ренатурации выделяют две стадии:
1. Бимолекулярная стадия нуклеации.
Образуется несколько "ядер"- участков спаривания.
Описывается реакцией второго порядка (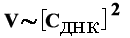 ).
).
2. Мономолекулярная стадия замыкания.
Скорость реакции пропорционально первой степени концентрации ДНК.
Это дальнейшее образование водородных связей - замыкание.
Процесс ренатурации описывается уравнением:  ,
,
где k - константа скорости ренатурации,
С - концентрация одноцепочечной ДНК.
В нулевой момент времени 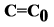 .
.
Тогда 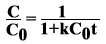 .
.
Если 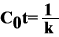 , то
, то  , и это полуренатурация.
, и это полуренатурация.
Таким образом мы получили характеристику  для описания разных молекул ДНК или их частей.
для описания разных молекул ДНК или их частей.
По значению  можно выделить 3 фракции:
можно выделить 3 фракции:
1. Быстрые повторы.
 меньше 0,01
меньше 0,01  .
.
Частота встречаемости на гаплоидный геном больше 105.
2. Умеренные повторы.
 от 0,01 до 1000
от 0,01 до 1000  .
.
Частота встречаемости на гаплоидный геном больше 10, но меньше 105.
3. Уникальные последовательности.
 больше 1000
больше 1000  .
.
Частота встречаемости меньше 10 раз на геном.
Есть отдельные последовательности, которые по значению  относятся к одному классу, а по частоте встречаемости - к другому. Это - палиндромы. Они ренатурируют мгновенно, т.к. отсутствует поиск комплементарной цепи, а их встречаемость в геноме может быть низка.
относятся к одному классу, а по частоте встречаемости - к другому. Это - палиндромы. Они ренатурируют мгновенно, т.к. отсутствует поиск комплементарной цепи, а их встречаемость в геноме может быть низка.
Значение  у палиндромов такое же, как и у быстрых повторов, а встречаемость, как у уников или умеренных повторов. У некоторых организмов, например, у черепах, 20% ДНК - палиндромы. В среднем у животных от 2% до 12% генома приходится на палиндромы. У растений - от 1% до 4% (у пшеницы 3 млн. обращенных повторов). Они могут содержать от нескольких десятков до десятков тысяч нуклеотидов. Наиболее часто палиндромы встречаются в регуляторных участках генов.
у палиндромов такое же, как и у быстрых повторов, а встречаемость, как у уников или умеренных повторов. У некоторых организмов, например, у черепах, 20% ДНК - палиндромы. В среднем у животных от 2% до 12% генома приходится на палиндромы. У растений - от 1% до 4% (у пшеницы 3 млн. обращенных повторов). Они могут содержать от нескольких десятков до десятков тысяч нуклеотидов. Наиболее часто палиндромы встречаются в регуляторных участках генов.
Гены tРНК - часто встречаемые палиндромы.
Быстрые повторы
К быстрым повторам относится сателлитная ДНК.
Особенности:
1. В этой короткой последовательности (6-10 нукл.) отсутствует один из нуклеотидов. Отсюда следует, что эта ДНК не может быть кодирующей, она никогда не транслируется. Встречается в конститутивном гетерохроматине.
Хромосома не гомогенна. В ней чередуются участки гетерохроматина (более плотный) и эухроматина (не плотные участки). В основном гены располагаются в эухроматине. Но встречаются и в гетерохроматиновых районах.
В зависимости от стадий клеточного цикла один и тот же участок хромосомы может быть в состоянинии как гетеро-, так и эухроматина. Такие участки хромосом называют факультативным гетерохроматином.
Участки, которые всегда уплотнены - конститутивный гетерохроматин. В нем, как правило, генов нет.
2. Сателлитная ДНК обязательно располагается в центромерном районе.
В местах расположения сателлитной ДНК возможна максимальная компактизация. В конститутивном гетерохроматине все четыре уровня упаковки ДНК представлены даже в интерфазе.
По сателлитной ДНК происходит кроссинговер между гомологичными хромосомами.
3. Сателлитная ДНК всегда располагается тандемно по 100-200 единиц в блоке. Образуются длинные последовательности в геноме.
4. У недавно образовавшихся на одной территории близких видов сателлитная ДНК заведомо разная.
Это обеспечивает бесплодие возможных межвидовых гибридов.
Все гены разделяют на гены "домашнего хозяйства" и гены "роскоши".
Гены "домашнего хозяйства" кодируют то, что всегда нужно любой клетке независимо от ткани.
По разным оценкам таких генов у человека 10-20 тыс. Это гистоновые гены, гены tРНК, rРНК и т.п. Гены "роскоши", которых заведомо больше в 2-3 раза, это гены, которые экспрессируются в клетках определенных тканей и в определенное время. Например, все гены белковых гормонов - гены "роскоши".
Умеренные повторы
К умеренным повторам относят как транскрибируемые и транслируемые, так и только транскрибируемые, но нетранслируемые последовательности ДНК и регуляторные участки.
| Умеренные повторы | ||
| гены | регуляторные участки | |
| транскрибируемые и транслируемые Гены белков рибосом, гистоновые гены, гены мембранных белков, цитоскелетных белков, гены иммуноглобулинов | транскрибируемые, но не нетранслируемые Гены rРНК, sРНК, tРНК | энхансерные модули, ori репликации, промоторы и терминаторы транскрипции |
Гены tРНК в среднем повторяются в геноме 5 тыс. раз. Гены sРНК - сотни тысяч раз.
Уникальные гены
У человека, по разным оценкам, 30-50 тыс. генов. Большинство генов - уникальны. Но даже в них есть повторяющиеся элементы. Это - некоторые экзоны.
Другая классификация генов
1. Уникальные гены, имеющие специализированную функцию.
Например, глобиновый, инсулиновый и другие гены. Они экспрессируются лишь в определенных клетках.
2. Уникальные гены, обладающие общими функциями, экспрессирующиеся в подавляющем большинстве клеток.
Эти гены плохо изучены.
3. Множественные сгруппированные гены.
Это гены rРНК, часть генов tРНК, часть гистоновых генов.
4. Множественные рассеянные гены.
Это оставшаяся часть гистоновых генов, оставшиеся гены tРНК и большинство генов sРНК, а так же МДГ (мобильные диспергированные (рассеяные) гены).
Лекция 11. Нестабильность генома.
В 40-х годах Барбара Мак-Клинток, американский генетик, обнаружила мозаичность окраски зерен у кукурузы, небъяснимую законами Менделя и мутационной теорией.
Она предположила, что некоторые гены могут менять свое место в геноме.
Определение: мобильные генетические элементы (МГЭ) - это последовательности нуклеотидов, меняющие свою локализацию и копийность в геноме.
Выделяют следущие классы МГЭ:
1. IS - вставочные элементы у прокариот.
2. Tn - транспозоны у прокариот.
3. Эписомы у прокариот.
4. Некоторые умеренные фаги.
5. Контролирующие элементы кукурузы.
6. Мобильные диспергированные гены у дрозофилы, мыши, человека.
7. Провирусы.
В литературе "транспозоны" - все мобильные генетические элементы. Это элементы генома, которые меняют свое положение и копийность в геноме.
IS-элементы
Это самые простые транспозоны.
Размер IS-элементов ~1000 п.н. На концах они содержат инвертированные повторы (~20 п.н.). IS- элементы содержат только один ген - ген транспозазы, фермента, обеспечивающего перемещение IS-элемента по геному.
Транспозаза - это обобщеный термин.
Разные транспозазы работают по-разному, но смысл общий:
транспозаза вырезает ДНК в одном месте и вставляет в другое место генома.
Перед геном в IS-элементе имеется промотор, за геном - слабый терминатор транскрипции. Не всегда РНК-полимераза останавливается на нем, она может продолжать транскрибировать и рядом стоящий участок генома до сильного терминатора.
Tn-транспозоны
Помимо гена транспозазы Tn-транспозоны содержат один или несколько генов лекарственной устойчивости. Копийность транспозона возрастает при наличии провокационного фона (например, наличие в среде антибиотика, ген устойчивости к которому кодируется в транспозоне).
Есть транспозоны, не содержащие гена транспозазы.
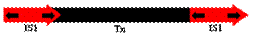
| Такие транспозоны содержат по краям IS-элементы. |
Размер транспозонов - 2.5-10 тыс. п. н.
Всем транспозонам свойственно наличие прямых повторов, LTR (long terminal repeats - длинные концевые повторы)
После перехода из основной ДНК в плазмиду транспозон может попасть с ней в другую бактерию, придавая новому хозяину ранее отсутствующую лекарственную устойчивость. Кроме того, при вырезании транспозона из геномной бактериальной ДНК захватываются участки генома одной бактерии, которые вместе с транспозоном переносятся в другую бактерию. Захват ДНК происходит, если эта ДНК находится между двумя транспозонами.
Умеренные фаги
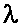 -фаг может захватывать часть генетической информации одной бактерии и переносить ее в другую. Поэтому сегодня говорят о едином генофонде прокариот.
-фаг может захватывать часть генетической информации одной бактерии и переносить ее в другую. Поэтому сегодня говорят о едином генофонде прокариот.
Эффекты, вызываемые мобильными элементами
- Внедрение мобильных элементов внутрь гена приводит к выключению гена.
- Может нарушаться регуляция гена, если мобильный элемент внедряется между оператором и цистроном (у мобильного элемента есть свой промотор).
- Вставка мобильного элемента может привести к экспрессии генов, которые не должны в данное время работать.
Наличие мобильных элементов является фактором, способствующим незаконной рекомбинации.
При незаконной рекомбинации перетасовываются гены, не имеющие отношения друг к другу.
Мобильные элементы провоцируют образование делеций, инверсий, дупликаций. Все это - хромосомные мутации.

| 
|
Некоторые вирусы - на самом деле тоже мобильные элементы. В форме провируса они находятся в геноме клетки хозяина, а потом могут начать перемещаться. Это, например, онкорнавирусы, являющиеся ретровирусами.
Молекулярные основы канцерогенеза
Признаки трансформированной клетки
1. Неконтролируемое деление.
Искажен клеточный цикл. Продолжителен S-период. Стадия G2 сведена к минимуму. Клетка вступает в митоз неготовой.
Последствия: нарушения при расхождении хромосом.
Высокая потребность в энергии. При этом в элокачественных клетках гликолиз (идущий без кислорода) превалирует над окислительным фосфорилированием.
2. Клетки перестают узнавать друг друга.
Происходит утрата контактного торможения. Это связано с изменением мембранных белков - белков-рецепторов и пр.
Нарушается адгезия (прилипание к поверхности).
3. Раковые клетки дедифференцированы.
Теории рака
До 70-х годов существовало три теории рака:
1. Канцерогенная теория.
Известны професиональные раковые заболевания: рак кожи у трубочистов, рак губы у кровельщиков и пр.
Бензпирен - первый описанный канцероген.
Определение: канцерогены - это вещества, повышающие частоту возникновения рака.
Но в экспериментах с канцерогенами не все животные заболевали.
2. Генетическая теория.
Появилась в 30-х годах. У лабораторных мышей известны высоко- и низкораковые лабораторные линии
3. Вирусная теория.
В молоке мышей был найден "фактор молока" (вирус Битнера).
Объединение всех этих теорий произошло в 50-х годах. Отечественный ученый Лев Зильбер высказал гипотезу, что причиной рака может быть вирус, который становится геном.
Обратная транскрипция
Определение: обратная транскрипция - это синтез ДНК по матрице РНК.
Обратную транскрипцию обнаружили в 1970 г. Темин, Балтимор, Дульбеко, работавшие с вирусом саркомы Рауса (ВСР). Этот вирус вызывает саркому у кур. Это онкорнавирус (oncoRNA) - относится к ретровирусам.
Определение: ретровирусы - это РНК-содержащие вирусы, в жизненный цикл которых входит стадия образования ДНК обратной транскриптазой и внедрение ее в геном клетки хозяина в форме провируса.
Предпочтительного места внедрения провируса в геном нет. Это позволяет отнести его к мобильным генетическим элементам.
В состав ретровируса входит две идентичные молекулы РНК. На 5'-конце имеется Сap, на 3'-конце - поли А-хвост. Фермент обратную транскриптазу вирус "носит" c собой.
| Геном ретровируса содержит 4 гена: | 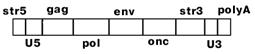
|
gag - белок нуклеоида,
pol - обратная транскриптаза,
env - белок капсида (оболочки),
onc - онкоген, ответственный за злокачественную трансформацию клетки.
str5 = str3 - (short terminal repeat) короткий концевой повтор;
U5, U3 - уникальные последовательности (U5 - 80 н., U3 - 200 н.);
PB (primer binding site) - участок связывания затравки.
| На РВ садится (за счет комплементарности) tРНК и служит затравкой для синтеза ДНК. Синтезируется небольшой кусок ДНК. |
Обратная транскриптаза, обладая еще и активностью РНК-азы Н, удаляет РНК в гибриде с ДНК, а за счет идентичности str3 и str5 этот одноцепочечный участок ДНК взаимодействует с 3'-концом второй молекулы РНК, которая служит матрицей для продолжения синтеза цепи ДНК.
Затем РНК-матрица уничтожается и по образовавшейся цепи ДНК строится комплементарная.
Образованная молекула ДНК длиннее РНК. Она содержит LTR (U3 str 3(5) U5). В форме провируса она находится в геноме клетки хозяина. При митозе и мейозе передается дочерним клеткам и потомкам.
Для экспрессии вирусных генов нужен толчок: канцерогены, изменения метаболизма в клетке хозяина, стресс.
Большинство изученных вирусных онкогенов кодируют протеинкиназу, фермент, который фосфорилирует белки. Как правило - это тирозиновая протеинкиназа. В клетке есть собственные протеинкиназы, в том числе и тирозиновая, но гораздо более активны сериновая и треониновая. Гены, кодирующие клеточные протеинкиназы, обозначают oncc, вирусные - oncv. Oncc - клеточные гены, работающие в дифференцированных клетках. Oncc имеют интроны, oncv - не имеют. Oncv либо добавляет тирозиновую протеинкиназу - и сказывается дозовый эффект гена тирозиновой протеинкиназы, либо, по сравнению с клеткой, не имеющей oncv, клетка, его имеющая, фосфорилирует тирозин, а не серин или треонин, как обычно, то есть происходит смена мишени.
В первую очередь это касается белков, присутствующих в клетке в большом количестве. Это белки цитоскелета (нарушение адгезии), мембранные белки (нарушение контактного торможения), гистоны (нарушение регуляции, компактизации, облегчение репликации ДНК).
Ретровирусы скорее всего возникли в результате внедрения мобильных элементов в непосредственной близости от oncc генов. В дальнейшем oncc превратился в oncv, а клеточная полимераза - в обратную транскриптазу. Вирус начал самостоятельную жизнь. Стадия провируса говорит о его клеточном происхождении.
В медицине рак - это злокачественная опухоль только эпителиальных тканей.
Метастазы - возникающие опухоли в районе удаления от исходной опухоли.
Рак - болезнь генома.
Одним из путей активации oncc является такая перестройка генома, в результате которой рядом с онкогеном появляется новый регуляторный элемент, обеспечивающий его более активную транскрипцию.
Другой путь - структурная мутация в протоонкогене, т.е. нормальном клеточном гене, способном превратиться в онкоген.
Существуют антионкогены, или гены-супрессоры опухолей, подавление активности которых приводит к развитию опухолей.
Природа белковых продуктов онкогенов и антионкогенов чрезвычайно разнообразна. К онкогенам относят некоторые гены белков - факторов роста, а также гены рецепторов факторов роста. Перепроизводство факторов роста или нарушение структуры их рецепторов может привести к более частому делению клеток. Изменения в генах, кодирующих белки - передатчики сигналов от рецепторов к ядру клетки, в основном, протеинкиназы различной специфичности, а также изменения экспрессии генов, ответственных за белковые факторы транскрипции, могут превратить нормальную клетку в раковую.
Подавление активности генов, ответственных за рост и размножение клеток, осуществляется белковыми продуктами генов - супрессоров опухолей. Так, ключевая роль в разрешении на переход из одной фазы клеточного цикла в другую принадлежит белкам - циклинам. Только находясь в комплексе с циклинами, циклинзависимые протеинкиназы способны фосфорилировать белки мишени, необходимые для перехода в следующую фазу клеточного цикла.
Специальные белки сканируют ДНК перед репликацией на предмет выявления нерепарированных повреждений. Если ДНК не проходит тест, то включаются системы реализации "запрограммированной смерти" - апоптоза, в результате чего разрушаются жизненно важные структуры клетки, в том числе хромосомы и цитоскелет. Апоптоз определяется большим числом генов, центральное место среди которых занимает ген, кодирующий белок с молекулярным весом 53 кДа, - ген p53. Этот ген поврежден в 50% всех опухолей человека. Когда он выведен из строя, клетки с поврежденной (мутантной) ДНК перестают выбраковываться и в них происходит накопление новых мутаций, которые могут затрагивать как протоонкогены, так и гены-супрессоры опухолей.
Как правило, рак развивается у людей пожилого и старого возраста. Это связано с тем, что мутации возникают случайно - и вероятность накопления в клетке нужного для злокачественного превращения набора измененных генов увеличивается с годами. Посчитано, что в среднем в клетке человека должно накопиться 10 независимых мутаций, касающихся онкогенов и генов - супрессоров опухолей.
Лекция 12. ВОЗНИКНОВЕНИЕ ЖИЗНИ
Основные гипотезы:
Панспермия - жизнь витает в космосе и разносится по планетам.
Жизнь зародилась абиогенно или нет?
Биогенез - живое только от живого.
Абиогенез - живое от неживого.
Луи Пастеру принадлежит первое прямое доказательство происхождения живого только от живого. В 1862 году он получил премию Французской академии наук за эту работу.
Суть опыта: в колбе с изогнутой трубкой находился прокипяченный сенный настой. В течение нескольких недель он стоял совершенно прозрачный. Как только колбу наклонили (сквозь трубку в колбу попали микроорганизмы) - настой забродил.
Эксперимент правильный. Вывод - живое только от живого.
Авторитет Пастера был столь велик, что к теории абиогенеза пришли лишь через 60 лет.
В 1924 году Александр Опарин высказал предположение, что ~4 млд. лет назад жизнь могла возникнуть абиогенно, в силу тех условий, которые существовали тогда на Земле.
Джон Холдейн рассчитал, какие условия и как долго должны были существовать, чтобы зародилась жизнь, каковы необходимые источники энергии для зарождения жизни.
Теория биопоэза
Джон Бернал создал теорию биопоэза, включающую три стадии.
1. Образование биомономеров.
2. Образование биополимеров и их эволюция. Образование систем с обратной связью.
3. Образование мембранных структур и пробионтов (первых клеток).
Экспериментальное доказательство первой стадии - опыты Стенли Миллера.
Суть опыта: в колбе находилась смесь газов (H2, N2, NH3, CH4, CO, CO2) при температуре ~ 100 0C. Кипящая вода служила источником водяного пара, а с помощью обратного холодильника поддерживалась циркуляция газовой смеси через сосуд. Давали искровой разряд в 60 тыс. вольт, что энергетически эквивалентно 50-и млн. лет на примитивной Земле. Результат был ошеломляющий: в колбе появились HCN, HCHO, HCOOH, несколько аминокислот, несколько азотистых оснований жирные кислоты, псирты, моносахара. Эксперимент повторяли много раз. Неперменное условие успеха - отсутствие в колбе свободного кислорода. В зависимости от pH раствора и соотношения газов были получены разные наборы соединений. Если была H3PO4, то образовывались даже нуклеотиды, а это уже гетерополимеры.
Таким образом была доказана первая стадия возникновения жизни. 4 млрд. лет тому назад с неизбежностью должны были возникнуть биомономеры.
Первичная атмосфера образующейся Земли кислород содержала, но он весь пошел на окисление. Свободного кислорода не было. Таким образом, возникновение биомономеров и биополимеров происходило во вторичной бескилородной среде.
У стадии 3 в принципе есть доказательства. Самая сложная и неочевидная - стадия 2.
2 стадия биопоэза.
Помимо 4-х основных классов биополимеров, могли образовываться и не дошедшие до нас гетерополимеры. Видимо, эволюция химических соединений шла по принципу минимума свободной энергии.
Остановимся пока на белках и нуклеиновых кислотах.
Из разных комплексов белок-нуклеиновая кислота рассмотрим только те, в которых
нуклеиновая кислота сохраняется благодаря защите белком от ультрафиолетового излучения.
Накопим такие комплексы. Из их множества рассмотрим те, в которых белки способствуют увеличению количества защищенной нуклеиновой кислоты. То есть эти белки - ферменты. Из этих комплексов рассмотрим те, где нуклеиновые кислоты, количество которых возрастает под действием белков, способствуют увеличению количества белков благодаря, например, прямому кодированию. Возникают системы с обратной связью. Такие системы обладают некоторыми признаками живого.
Другой вариант.
Первыми молекулами были РНК.
Они имеют третичную структуру и обладают каталитической активностью. Позже появились белки, поддерживающие "выгодные" конформации РНК и защищающие их от расщепления. Уже потом возникает ДНК, как более надежный хранитель генетической информации. Она имеет две цепи, что обеспечивает репарацию, репликация осуществляется за один шаг. Отсутствие ОН-группы в 2'-положении пентозы делает ДНК устойчивой в слабощелочных условиях, губительных для РНК.
Стадия 3.
Представим, что лужа покрыта жирной пленкой, а под ней - белки. Если оторвать каплю, то могут получиться пузырьки, содержащие нуклеопротеидные системы с обратной связью. Когда они падают на поверхность водоема, то покрываются вторым липидно-белковым слоем - и образуется современная биологическая мембрана. В мембранной капле диффузия уже не очень существенна.
Далее образуются пробионты - первые организмы, имеющие мембрану.
Эволюция пробиотов
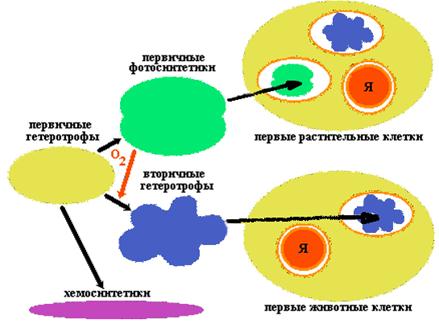
|
Пробионты были первичными гетеротрофами. Они получали энергию при расщеплении органических веществ абиогенного происхождения, в изобилии имевшихся в окружающей среде. Примером древнего способа обмена веществ, дошедшего до наших дней, является гликолиз - ферментативное бескислородное расщепление глюкозы.
По мере истощения запаса органического материала (а новый не образовывался из-за изменения условий на Земле) возникала жесткая конкурентная борьба за него, что ускорило процесс эволюции первичных гетеротрофов.
Исключительным событием стало возникновение бактериального фотосинтеза, освободившего клетки от зависимости от доступности органики абиогенного происхождения. Скорее всего, фотосинтез возник у анаэробных бактерий, способных к азотофиксации. Побочным продуктом фотосинтеза является кислород. Его накопление в атмосфере привело к коренному изменению хода эволюции. Появление озонового экрана защитило первичные организмы от смертельного УФ-облучения и положило конец абиогенному синтезу органики.
Первые аэробные бактерии появились благодаря приобретению аппарата окислительного фосфорилирования. Продукты брожения подвергались дальнейшему окислению до СО2 и Н2О. Аэробные (вторичные) гетеротрофы могли более эффективно, чем анаэробные (первичные) гетеротрофы, расщеплять органические вещества, образующиеся в результате фотосинтеза.
По-видимому, с ростом концентрации кислорода в атмосфере усложнялась жизнь первичных анаэробных гетеротрофов. Некоторые из них вымерли, другие нашли бескислородную среду. Примером могут служить дошедшие до наших дней метанобразующие бактерии или серные бактерии, живущие в горячих подземных источниках.
Некоторые первичные гетеротрофы пошли по пути, приведшему к образованию эукариотических клеток. Часть из них вступила в симбиоз с аэробными бактериями, способными к окислительному фосфорилированию. Поглотив вторичных гетеротрофов, первичные не расщепили их на молекулы, а сохранили в качестве энергетических станций, называемых сегодня митохондриями.
Такие симбионты дали начало царствам животных и грибов.
Другая часть первичных гетеротрофов "заключила союз" не только с аэробными гетеротрофами, но и с первичными фотосинтетиками, сохранив последних в качестве хлоропластов. Такие симбионты дали начало царству растений.
В пользу симбиотической теории образования эукариот говорят следующие факты:
- У митохондрий и хлоропластов две мембраны. Внутренняя - своя, наружняя образована клеткой-захватчиком.
- Генетический код митохондрий идеален. Универсальный генетический код имеет два существенных отличия, касающихся инициации и терминации синтеза белка.
Таким образом эукариоты отстранились от чужой генетической информации.
Кроме того, они линеаризовали свою ДНК. Митохондрии и хлоропласты имеют кольцевую ДНК, хотя не очень понятно, для чего им нужна кольцевая ДНК, и бактериальные рибосомы. Однако понятно, почему у них такая ДНК и такие рибосомы. Потому, что их предки были бактериями. Сегодня часть генов митохондриальных белков и белков хлоропластов, в том числе их РНК- и ДНК-полимераз, находятся в ядре. Вероятно, попали они туда с помощью мобильных элементов.
Поиск по сайту: