 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
НЕФТИ И ГАЗА им. И.М. ГУБКИНА
РОССИЙСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Факультет химической технологии и экологии
Кафедра органической химии и химии нефти
Литературный синтез
на тему:
“Йодбензол”
Выполнил: студент гр. ХТ–01–3
Судаев С. А.
Проверил: доц. Ачкасова Л. Г.
Москва 2003
Содержание
стр.
1. ВВЕДЕНИЕ…………………………………………………………….
2. ТЕОРЕТИЧЕСКАЯ ЧАСТЬ………………………….
2.1 Формула соединения и его названия
2.2 Физические свойства соединения
2.3 Химические свойства соединения
2.4 Методы получения соединения
2.5 Основание выбора схемы синтеза соединения
3. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ……………………………………
3.1 I стадия синтеза
3.1.1 Уравнение основной и побочной реакции
3.1.2 Таблица «Характеристики и количества исходных реагентов
и продукта реакции»
3.1.3 Описание синтеза, константы полученного соединения,
выход его, в % от теоретического
3.2 II стадия синтеза
3.2.1 Уравнение основной и побочной реакции
3.2.2 Таблица «Характеристики и количества исходных реагентов
и продукта реакции»
3.2.3 Описание синтеза, константы полученного соединения,
выход его, в % от теоретического
4. ВЫВОДЫ
5. ЦИТИРОВАННАЯ ЛИТЕРАТУРА
6. ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
ВВЕДЕНИЕ
2. Теоретическая часть
2.1 Формула соединения и его названия
Синтезируемое вещество имеет тривиальное название фенил йодистый и по номенклатуре ИЮПАК - йодбензол
Брутто-формула: С6Н5I
3.1
3.1.1 Уравнение основной реакции:
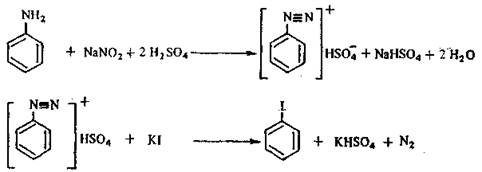
3.1.2 Таблица – 1 «Характеристики и количества исходных реагентов
и продукта реакции»
| Название реактивов | Брутто-формула | Мол. масса | Основные константы | Количества исходных реагентов | |||||||
| Ткип., 0С | Тпл., 0С | d420, г\см3 | по реакции | по методике | изб. | ||||||
| г | г\моль | г | мл | г\моль | г\моль | ||||||
| йодбензол | С6Н5I | 204,01 | 188,6 | -31,4 | 1,832 |
3.1.3Описание синтеза, константы полученного соединения,
выход его, в % от теоретического
Реактивы: анилин—10 г (9,9 мл); серная кислота (р=1,84 г/см3)—20,2г; нитрит натрия — 7,7 г; иодид калия — 29 г; гидроксид натрия, 10%-ный раствор— 32 мл; хлорид кальция (безводный); мочевина сухая.
Посуда и оборудование: стакан фарфоровый вместимостью 250 мл; капельная воронка; термометр; мешалка; холодильник шариковый; установка для перегонки с водяным паром; делительная воронка; колба Вюрца; круглодонная колба вместимостью 1 л.
В фарфоровый стакан, снабженный капельной воронкой и термометром, помещают 9,9 мл анилина, 11 мл концентрированной серной кислоты, растворенных в 65 мл воды. Смесь охлаждают до 0°С и из капельной воронки постепенно вносят 7,7 г нитрита натрия, растворенного в 45 мл воды. Температура во время диазотирования не должна превышать +5°С. После введения всего нитрита натрия смесь перемешивают при охлаждении еще
1 ч, после чего избыток азотистой кислоты удаляют добавлением сухой мочевины (до прекращения выделения газов). Затем к раствору диазосоединений осторожно приливают раствор 29 г иодида калия в 35 мл воды и смесь оставляют при той же температур, в течение 1 ч. Затем содержимое стакана переносят в круглодонную колбу с обратным шариковым холодильником и нагревают на водяной бане до прекращения выделения азота. Смесь подщелачивают 32 мл 10%-ного раствора гидроксида натрия, отгоняют йодбензол из этой же колбы с водяным паром, отделяют в делительной воронке от воды, сушат прокаленным хлоридом кальция и перегоняют из колбы Вюрца. Собирают фракцию с т, кип. 189... 190°С.
Выход 21,5 г (98% от теоретического).
Йодбензол — бесцветная жидкость, не растворяется в воде, но хорошо растворяется в спирте, эфире, хлороформе. Т. пл. —31°С, т. кип. 188,5°С,
р 15= 1,8383, n 18D= 1,6213.
УФ-Спектр (в гептане): [λмакс.(lg ε)]: 257 нм (2,8), спектр ЯМР (в СDС13): мультиплет 7,57; 7,41; 7,34 м. д.
Литература
1. Реферативный журнал “Химия” (РЖХим).
2. Бельштейн
3. Краткая химическая энциклопедия. Под ред. И. Л. Кнуньянца Т.2 М.: “Советская энциклопедия”, 1963 - 1088 с.;
2. Лабораторные работы по органической химии. Под ред. О. Ф. Гинзбурга и А. А. Петрова, М.: “Высшая школа", 1982 – 269 с.;
Поиск по сайту: