 |
АвтоАвтоматизацияАрхитектураАстрономияАудитБиологияБухгалтерияВоенное делоГенетикаГеографияГеологияГосударствоДомДругоеЖурналистика и СМИИзобретательствоИностранные языкиИнформатикаИскусствоИсторияКомпьютерыКулинарияКультураЛексикологияЛитератураЛогикаМаркетингМатематикаМашиностроениеМедицинаМенеджментМеталлы и СваркаМеханикаМузыкаНаселениеОбразованиеОхрана безопасности жизниОхрана ТрудаПедагогикаПолитикаПравоПриборостроениеПрограммированиеПроизводствоПромышленностьПсихологияРадиоРегилияСвязьСоциологияСпортСтандартизацияСтроительствоТехнологииТорговляТуризмФизикаФизиологияФилософияФинансыХимияХозяйствоЦеннообразованиеЧерчениеЭкологияЭконометрикаЭкономикаЭлектроникаЮриспунденкция
Углерод, кремний
Лабораторная работа №6
Цель работы: изучение химических свойств углерода и кремния, в том числе: свойства их производных, солей и полимерных соединений.
Опыт 1: Активированный уголь.
В стакан поместили несколько кусочков древесного угля и залили водой. Нагревали до тех пор, пока уголь не утонул. Затем его высушили на фильтровальной бумаге и поместили в фарфоровый тигель. Закрыли крышкой и прокаливали в течении нескольких минут при 500°С. Затем охладили в эксикаторе, поместили уголь в пробирку, залили слабым раствором фуксина и взболтали. Раствор обесцветился. Это обусловлено тем, что древесный уголь стал активированным и добавленный фуксин адсорбировался на развитой внутренней поверхности пор угля.
Вывод. Экспериментально получили активированный уголь и на опыт проверили что он является хорошим адсорбентом.
Опыт 2: Оксид углерода (II).
Оксид углерода (II) получили нагреванием в пробирке с газоотводной трубкой щавелевой кислоты с концентрированной серной кислотой. Пропустили через аммиачный раствор нитрата серебра, светло-розовый сернокислый раствор перманганата калия и светло-оранжевый сернокислый раствор дихромата калия. В первом случае выпал черный осадок, во втором – раствор обесцветился, в третьем – окраска раствора изменилась на зелёную.








 + 4
+ 4 





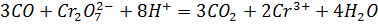
Вывод. Получили монооксид углерода и рассмотрели его восстановительные свойства.
Опыт 3: Углекислый газ, угольная кислота и ее соли.
а) Универсальным индикатором измерили рН дистиллированной воды. рН = 6.Это обусловлено тем, что в ней растворен углекислый газ.
б) Из аппарата Киппа очищенным и осушенным углекислым газом (очистить можно пропусканием углекислого газа через дистиллированную воду, а осушить – пропусканием через концентрированную серную кислоту) наполнили три большие банки (чтобы убедиться, что банки полностью наполнены углекислым газом, надо горящую лучинку внести в банку: если пламя гаснет в верхней части банки, значит она полная). На слабое пламя горелки вылили содержимое одной из них. Пламя горелки затухает. Во вторую банку щипцами внесли горящий магний. Он продолжал гореть, и при этом сильно коптил. В третью внесли ложечку с горящим красным фосфором. Горение прекратилось. Таким образом, углекислый газ поддерживает горение магния, а фосфора – нет.

 2
2 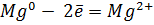
 1
1 



 4
4 
5 

в) В 0,1 н раствор щелочи добавили каплю раствора фенолфталеина и пропустили ток чистого углекислого газа из аппарата Киппа до исчезновения окраски. Затем раствор прокипятили. Окраска снова появилась.


г) Теоретически оценили рН раствора питьевой соды. Соответствующие константы диссоциации для угольной кислоты:
 ; Ka1=4,5*10-7
; Ka1=4,5*10-7
 ; Ka2=5*10-11
; Ka2=5*10-11

Для децинормального (0,1M)раствора питьевой соды в воде получаем:

д) Растворы хлоридов магния и алюминия обработали раствором соды. При взаимодействии с раствором хлорида магния выпадает белый осадок, при взаимодействии с хлоридом алюминия – студенистый белый осадок.


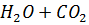



е) Для очистки карбоната от гидрокарбоната, сульфита и сульфата в водном растворе необходимо:
1. Прокипятить раствор. При этом: 
2. Произвести окисление перекисью водорода:

3. Титрованием установить точную концентрацию сульфата в растворе, рассчитать количество  , необходимое для его связывания, и прибавить к раствору, тщательно перемешивая.
, необходимое для его связывания, и прибавить к раствору, тщательно перемешивая.

4. Отфильтровать полученный раствор.
Вывод. Предложили рациональную схему очистки карбоната от примесей гидрокарбоната, сульфита и сульфата.
Опыт 4: Кремний.
Тщательно смешали равные навески порошков магния и кремнезёма и нагрели в пробирке до начала реакции. Реакционную массу охладили и обработали избытком соляной кислоты.


 2
2 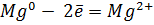
1 

Так как магний находится в избытке, он реагирует с образовавшимся кремнием:

После добавления соляной кислоты:
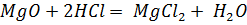
 реакция не идет
реакция не идет

Осадок отфильтровали, промыли дистиллированной водой и высушили. Затем испытали на растворимость в щелочах и кислотах.


 реакция не идет
реакция не идет
Вывод. Получили кремний ОВР с магнием. Рассмотрели кислотно-основные свойства кремния. Выяснили, что он проявляет только кислотные свойства.
Опыт 5: Кремниевый ангидрид, кремниевая кислота и их соли.
а) Конторский клей десятикратно разбавили дистиллированной водой и оттитровали 0,1 н соляной кислотой в присутствии фенолфталеина.
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl fэкв(Na2SiO3) = 1/2
 V1 = 19,38 мл
V1 = 19,38 мл
V2 = 19,42 мл Vср = 19,41 мл
V3 = 19,43 мл
V(Na2SiO3) * C(1/2 Na2SiO3) = V(HCl) * C(HCl)
C(1/2 Na2SiO3) = V(HCl) * C(HCl)/ V(Na2SiO3)
C(1/2 Na2SiO3) = 19,41 * 0,1 / 5 = 0,3882 моль/л
C(Na2SiO3) = 0,7764 моль/л
С учетом проведенного разбавления:
C(Na2SiO3) = 15,582 моль/л
б) В пробирку поместили несколько капель раствора конторского клея, прилили равный объем 2н соляной кислоты и взболтали. Образовался белый осадок, который растворяется в концентрированном растворе щелочи, но не растворяется в концентрированном растворе соляной кислоты. Образовавшийся осадок представляет собой кремниевую кислоту, поэтому она взаимодействует со щелочами, а с кислотами – нет.
Na2SiO3 + 2HCl = H2SiO3↓ + 2NaCl

H2SiO3  + 2NaOH = Na2SiO3 + 2H2O
+ 2NaOH = Na2SiO3 + 2H2O
H2SiO3  +2OH- =
+2OH- =  + 2H2O
+ 2H2O
H2SiO3  + HCl
+ HCl 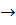 реакция не идет
реакция не идет
в) Смешали водные растворы конторского клея и хлорида аммония в объемном отношении 1:3. Раствор помутнел. Это обусловлено взаимным усилением гидролиза и протеканием его в этих условиях до конца.


г) В водный раствор конторского клея пропустили из аппарата Киппа ток очищенного углекислого газа. На поверхности раствора в пробирке образовалась плотная, прозрачная пленка геля.

д) В пробирку поместили 5 мл концентрированной соляной кислоты, добавили 1 мл водного раствора конторского клея и взболтали.


Образовался гелеобразный мутный раствор, содержащий мицеллы кремниевой кислоты:

е) Измерили рН равномолярных водных растворов карбоната и силиката натрия. рН(Na2CO3) = 9, pH(Na2SiO3) = 12. Отсюда можно сделать вывод о том, что угольная кислота сильнее кремниевой, а её соли менее подвержены гидролизу.
гидролиз по первой ступени:
Na2CO3 + H2O ↔ NaHCO3 + NaOH
CO32- + H2O ↔ HCO3- + OH-
Na2SiO3 + H2O ↔ NaHSiO3 + NaOH
SiO32- + H2O ↔ HSiO3- + OH-
гидролиз по второй ступени:
NaHCO3 + H2O ↔ NaOH + H2O + CO2↑
HCO3- + H2O ↔ OH- + H2O + CO2↑
NaHSiO3 + H2O ↔ NaOH + H2SiO3↓
HSiO3- + H2O ↔ OH- + H2SiO3↓
ж) Сильно нагрели конец стеклянной трубки и быстро опустили его в воду. Осколки тщательно растерли в ступке, смочили дистиллированной водой и добавили каплю фенолфталеина. Появилась малиновая окраска. Это обусловлено тем, что силикат натрия – это соль, образованная сильным основанием и слабой кислотой, а значит гидролизуется по аниону. Поэтому в растворе имеет щелочную среду. (Уравнения гидролиза в опыте 5е)
з) Наполнили стаканчик разбавленным водным раствором конторского клея и опустили в него по одному крупному кристаллику солей железа, кобальта, никеля и меди. Кристаллики стали увеличиваться в размерах и распределились по объему раствора.
Na2SiO3 + CuSO4 + 2H2O ↔ Cu(OH)2  + H2SiO3
+ H2SiO3  + Na2SO4
+ Na2SO4
SiO32- + Cu2+ +2H2O ↔ Cu(OH)2 ↓ + H2SiO3  (кристаллы синего цвета)
(кристаллы синего цвета)
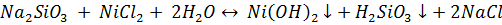
SiO32- + Ni2+ +  ↔ Ni(OH)2↓+
↔ Ni(OH)2↓+  (кристаллы зеленого цвета)
(кристаллы зеленого цвета)
Na2SiO3 + CoCl2 + 2H2O ↔ Co(OH)2  + H2SiO3
+ H2SiO3  + 2NaCl
+ 2NaCl
SiO32- + Co2+ + 2H2O ↔ Co(OH)2↓ + H2SiO3  (кристаллы фиолетового цвета)
(кристаллы фиолетового цвета)
Na2SiO3 + FeCl2 + 2H2O ↔ Fe(OH)2↓ + H2SiO3  + 2NaCl
+ 2NaCl
SiO32- + Fe2+ + 2H2O ↔ Fe(OH)2↓ + H2SiO3  (кристаллы красно-коричн. цвета)
(кристаллы красно-коричн. цвета)
и) В водный раствор конторского клея пропустили из аппарата Киппа ток очищенного углекислого газа до прекращения гелеобразования. Полученный гидрогель отфильтровали, промыли дистиллированной водой и высушили в вакуумном сушильном шкафу при 150°С в течении часа. Высушенный препарат охладили в эксикаторе и растерли в ступке. Часть препарата обработали слабым (светло-синим) аммиачным раствором сульфата меди. Раствор обесцветился, что свидетельствует об адсорбции ионов меди на внутренней поверхности гидрогеля.
Методика проведения десорбции. Сорбент с сорбатом поместить в фарфоровый тигель, высушить до удаления влаги и прокаливать при 500  в течение 10 мин. После охлаждения остаток обработать 1 М Н2SO4 (по 3 мл на 1 г сорбента), отфильтровать твердую фазу и промыть ее на фильтре небольшими порциями дистиллированной воды (5 мл). Фильтрат нейтрализовать до рН 4–5 и определить содержание меди.
в течение 10 мин. После охлаждения остаток обработать 1 М Н2SO4 (по 3 мл на 1 г сорбента), отфильтровать твердую фазу и промыть ее на фильтре небольшими порциями дистиллированной воды (5 мл). Фильтрат нейтрализовать до рН 4–5 и определить содержание меди.
Вывод. Изучили свойства кремния и его соединений. Выяснили, что элементарный кремний проявляет восстановительную активность, а его соединения не имеют выраженных окислительно-восстановительных свойств. Помимо этого легко наблюдать кислотные свойства кремния и его соединений. Помимо этого, оксид кремния в разных своих формах является хорошим адсорбентом.
Поиск по сайту: